'RNA-spons' mogelijk oorzaak van aftakeling zenuwcellen bij ALS/FTLD
11-04-2013
De meest voorkomende genetische oorzaak voor zowel ALS (Amyotrofische Laterale Sclerose) als FTLD (frontotemporale lobaire degeneratie) is een afwijking in het C9orf72-gen, zo is onlangs vastgesteld. Het blijft echter onduidelijk hoe de mutatie leidt tot deze neurodegeneratieve ziekten.
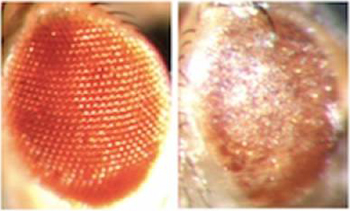
Foto: In 2011 ontdekten wetenschappers een mutatie die de meest voorkomende genetische oorzaak is van zowel ALS als FTLD. Door deze mutatie wordt de sequentie "GGGGCC" honderden malen herhaald op het C9orf72-gen.
Vergelijk twee ogen van fruitvliegjes. De vlieg rechts produceert schadelijk RNA op basis van de herhaalde GGGGCC-sequentie, wat leidt tot aftakeling van zenuwcellen.
Onderzoekers van de Emory University School of Medicine hebben aangetoond dat de ALS/FTLD-mutatie mogelijk schadelijk is omdat deze een "RNA-spons" creëert die een belangrijk regulerend RNA-bindend eiwit opzuigt.
De resultaten zijn woensdag online gepubliceerd in de Proceedings of the National Academy of Sciences, Early Edition.
"Wij denken dat het RNA zelf deel uitmaakt van het ziektemechanisme," aldus medeauteur Dr. Thomas Wingo, assistent-professor neurologie aan de Emory University School of Medicine. "Zowel in celculturen als bij fruitvliegjes hebben we kunnen aantonen dat we het eiwit dat is weggenomen door het RNA weer kunnen aanvullen en daarmee het probleem verlichten."
Deze bevinding werpt licht op het ziektemechanisme van ALS en FTLD, zowel wanneer sprake is van een C9orf72-mutatie als bij andere gevallen. Het duidt erop dat er overeenkomsten bestaan tussen bepaalde vormen van ALS/FTLD en andere neurodegeneratieve stoornissen die worden veroorzaakt door niet-coderende herhaalde sequenties, zoals myotone dystrofie, spinocerebellaire ataxie en fragieleX–gerelateerde tremor/ataxiesyndroom (FXTAS).
De hoofdauteur van het onderzoek is Peng Jin, PhD, professor menselijke genetica aan de Emory University School of Medicine. De eerste auteurs zijn Zihui Xu, PhD, voormalig student van Peng Jin en thans verbonden aan de Huazhong University of Science and Technology in China, en onderzoekspecialist Mickael Poidevin.
ALS is een dodelijke ziekte waarbij motorneuronen in de hersenen en het ruggenmerg langzaam afsterven. Naarmate de ziekte vordert, verliest de patiënt het vermogen te lopen, praten en ademen. FTLD is een vorm van degeneratie die voornamelijk het gedrag, de persoonlijkheid en de taalbeheersing van de patiënt aantast.
Veel neurologen en onderzoekers zijn van mening dat deze twee aandoeningen klinische en pathologische overeenkomsten delen. Mutaties in verschillende genen zijn in verband gebracht met zowel ALS als FTLD, wat erop kan duiden dat er sprake is van een gemeenschappelijk ziektemechanisme. De meeste gevallen worden echter getypeerd als sporadisch, wat betekent dat er geen duidelijke familiale (erfelijke) factoren aanwezig zijn.
In 2011 werd een bepaalde C9orf72-mutatie geïdentificeerd die de meest voorkomende genetische oorzaak bleek te zijn voor ALS en FTLD. Bij beide aandoeningen was deze mutatie verantwoordelijk voor 5 tot 7% van alle ziektegevallen. De mutatie lijkt niet van invloed op het eiwit dat wordt gecodeerd door C9orf72, maar zorgt voor een veelvoudige herhaling van een blokje repetitieve DNA, waardoor de sequentie "GGGGCC" honderden malen wordt herhaald buiten de gedeelten van het gen dat het eiwit codeert.
Dit lijkt erg op de niet-coderende herhaalde sequenties die verantwoordelijk zijn voor andere neurodegeneratieve stoornissen zoals myotone dystrofie, spinocerebellaire ataxie en fragieleX–gerelateerde tremor/ataxiesyndroom (FXTAS).
Een aantal onderzoekers hebben beschreven hoe de herhaalde GGGGCC-sequentie RNA produceert dat op zijn beurt wordt vertaald in een ongewoon eiwit dat zich ophoopt in cellen. Zij denken dat deze ophopingen van eiwit schadelijk zijn voor neuronen. Onderzoekers van de Emory universiteit hebben een andere verklaring: de RNA die wordt geproduceerd aan de hand van de herhaalde GGGGCC-sequentie is zelf schadelijk.
Het team van Emory heeft de uitwerking onderzocht van deze RNA in een celcultuur van zenuwcellen van zoogdieren. Zij stelden vast dat de RNA schade toebracht aan de zenuwcellen. Bij proeven met fruitvliegjes zagen zij dat de RNA leidde tot degeneratie van zenuwcellen. Wanneer de RNA werd geproduceerd in de motorneuronen van de vliegjes, leidde dit tot verminderd motorisch vermogen.
De RNA die wordt geproduceerd op basis van de herhaalde GGGGCC-sequentie is schadelijk omdat deze bij overproductie het eiwit Pur alpha isoleert. Dit eiwit bindt zich aan herhaalde GGGGCC-sequentie. Van Pur alpha was al vastgesteld dat deze noodzakelijk is voor een goede ontwikkeling van zenuwcellen en betrokken is bij het transport van RNA binnen zenuwcellen. Door de zenuwcellen of de vliegjes ter compensatie meer Pur alpha te laten produceren wordt de schadelijke werking van het RNA tegengegaan, zo vonden de onderzoekers van Emory.
"Dit suggereert dat ALS en FTLD mogelijk kunnen worden bestreden door middel van het aanpakken van de schadelijke RNA zelf of door in te grijpen in de wisselwerking van het RNA en Pur alpha," aldus Jin. "Ook lijkt dit erop te duiden dat er een gemeenschappelijk RNA-gerelateerd mechanisme bestaat dat bijdraagt aan het ontstaan van meerdere neurodegeneratieve ziekten."
Het isoleren van Pur alpha lijkt te leiden tot een andere verdeling van het eiwit binnen de zenuwcellen van ALS- en FTLD-patiënten. Het team van Emory heeft samenklonteringen met daarin Pur alpha gevonden in hersenweefsel van mensen met C9orf72-mutaties – en ook bij andere FTLD-patiënten zonder C9orf72-mutatie.
Het onderzoek is ondersteund door het National Institute for Neurological Disorders and Stroke (R01 NS051630 andR21 NS067461) en de Atlanta Veterans Administration Medical Center.
Referentie: Z. Xu, M. Poidevin, X. Li, Y. Li, L. Shu, D.L. Nelson, H. Li, M. Gearing, T.S. Wingo en P. Jin. Expanded GGGGCC repeat RNA associated with amyotrophic lateral sclerosis and frontotemporal dementia causes neurodegeneration. PNAS Early Edition (2013).
Bron: Emory University


