Durchtesten einer neuen Behandlung in einem ALS Mausmodell
19-07-2018

Neurobiologisches Labor
VIB – KU Leuven Center for Brain & Disease
Herestraat 49 bus 602, 3000 Leuven
Prof. Dr. Ludo Van Den Bosch
PhD Student: Elisabeth Rossaert
Zusammenfassung des Forschungsprojekts
Zur Entwicklung neuer therapeutischer Behandlungen die amyotrophische laterale Sklerose (ALS) heilen oder verlangsamen, wurde in den letzten Jahren intensive Recherche betrieben zu den zugrunde liegenden Mechanismen die ALS verursachen..
Vor kurzem wurde entdeckt, daB Transkription gestört verlauft im Rȕckenmark der Patienten. Transkription bedeutet der ProzeB bei dem aus dem genetischen Material (DNA) ein Bote RNA (mRNA) entsteht. Aus diesem mRNA werden Proteine angefertigt, die u.a. die Bausteine jeder motorischen Nervenzelle bilden. Im Falle einer Fehlfunktion der Transkription hat das groBe Folgen fȕr die normale Operation und also fȕr die Überlebenschancen der motorischen Nervenzellen, die im Falle von ALS selektiv absterben.
Es ist möglich um die wahrgenommene Transkriptionsstörungen zu reparieren durch das beeinfluBen eines der wichtigsten Regler dieses Prozesses, die epigenetischen Marker. Diese kann man beschreiben als eine “zweite Informationsschicht” in und um das DNA. Diese sind chemische Strukturen die den ProzeB der Transkription stärken oder schwächen. Diese beeinfluBen also die Rate in der das DNA transkribiert wird zu mRNA Molekȕlen. Diese Marker können dem DNA direkt gehören, oder sich an Histonen haften. Diese sind “Proteinpackungen” die das DNA kompakt zusammenfalten.
Der fȕr die Studie relevante epigenetische Marker ist die Azetylierung von Histonen. Dieser Marker regt die Transkription an. Histonacetylasen sind Proteine die Azetylgruppen an Histonen binden. Die Abspaltung der Azetylgruppen wird durchgefȕhrt von Histon-Deazetylasen (HDACs) die die Transkription negativ beeinfluBen. Eine Medizin die HDACs unterdrȕckt wȕrde diesen letzten ProzeB (die Abspaltung von Azetylgruppen) weitgehend zurȕckhalten. Dies erhöht die Menge an Azetylierung und hat so einen gȕnstigen EinfluB auf die Transkription. Sie sorgt mit anderen Worten fȕr die Produktion von ausreichenden Proteinen nötig fȕr die Zelle zum Űberleben.
Ziel dieser Studie ist das therapeutische Potential einer HDACs unterdrȕckenden Medizin (ein HDAC Inhibitor) mittels ALS Mausmodell zu testen.
Diese Forschung erhöht unser Verständnis hinsichtlich der Rolle der epigenetischen Marker auf die Funktionsweise sowie die Űberlebenschancen von Motoneuronen. Darauf aufbauend wird uns dann die Wirkung bestimmter Medikamentedie diese Marker beeinfluBt klar. Zum testen neuer therapeutischer Strategien gegen ALS sind diese Einblicke absolut notwendig.
Warum Mäuse als Tiermodell?
Das nervöse System ist ein sehr komplexes Organ. Für diese Art von Forschung bleibt es daher unerlässlich daB das Modellgehirn dem des Menschen gleicht. Die fȕr ALS relevante und krankheitsbetroffenen motorischen Nervenzellen sollten studiert werden in einem biologisch relevanten Zusammenhang
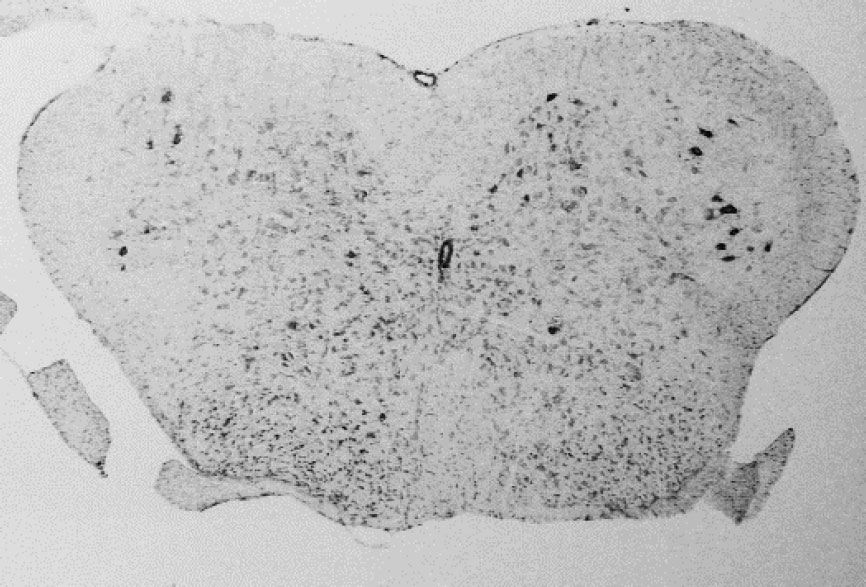 HDas Mausmodell wird derart genetisch manipuliert daB es die gleichen pathologischen Eigenschaften zeigt wie bei ALS Patienten. Die Mäuse entwickeln motorische Probleme und sterben frȕhzeitig, kurz nachdem die ersten Symptome aufgetreten sind. Pathologische Forschung hat gezeigt, daB die motorischen Nervenzellen im Rȕckenmark (siehe Bild) der Mäuse sterben und daB demzufolge Muskelschwäche und Lähmungserscheinungen auftreten.
HDas Mausmodell wird derart genetisch manipuliert daB es die gleichen pathologischen Eigenschaften zeigt wie bei ALS Patienten. Die Mäuse entwickeln motorische Probleme und sterben frȕhzeitig, kurz nachdem die ersten Symptome aufgetreten sind. Pathologische Forschung hat gezeigt, daB die motorischen Nervenzellen im Rȕckenmark (siehe Bild) der Mäuse sterben und daB demzufolge Muskelschwäche und Lähmungserscheinungen auftreten.
Wegen ihrer starken Ähnlichkeit mit Patienten bietet die Forschung mit ALS Mäusen eine einmalige Gelegenheit um den KrankheitsprozeB weiterhin zu studieren und zu verstehen. AuBerdem erlaubt sie um neue Therapien auf sichere und direkte Weise zu testen.
Arbeitsplan
Im Rahmen dieser Studie werden ALS Mäuse behandelt mit einem HDAC Inhibitor sobald die ersten motorischen Symptomen auftreten. Die Mäuse nehmen die Medizin durch ihre Ernährung. Dann wird der Effekt der Behandlung überprüft durch sowohl die Mobilität als das Überleben der Mäuse eng zu verfolgen. AuBerdem meBen wir die Leitung der motorischen Nervenzellen zu den Muskeln mit einer spezialisierten Maschine.
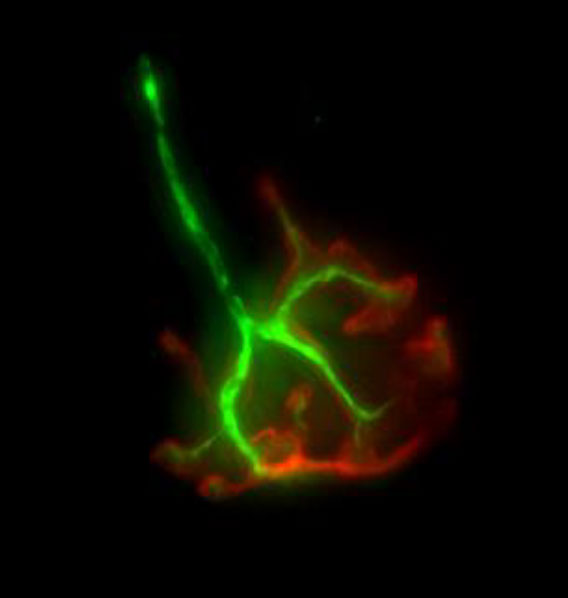
AnschlieBend untersuchen wir den Effekt der Behandlung auf das Űberleben der motorischen Nervenzellen im Rȕckenmark, sowie auf die Nerven der Muskeln (siehe Bild). Durch Färben von Gewebeschnitten wird unter dem Mikroskop ersichtlich ob eine Verbesserung in der behandelten Gruppe von Mäusen auftritt. Diese wird mit einer unbehandelten Kontrollgruppe verglichen.
AuBerdem studiert diese Forschung den Effekt der Medizin auf die Transkription im Rȕckenmark unter Verwendung von RNA-Sequenzierung. Es handelt sich um einer hohen Technologie zur Kartierung des Transkriptoms. Dank dieser Forschung erhalten wir neue Einblicke in demjenigen, was schief läuft beim KrankheitsprozeB.
Geschätzte Kosten: € 160000 fȕr 2 Jahre
Dieses Projekt läuft bereits, dank der Unterstȕtzung der ALS Liga. Wir konnten demonstrieren daB die ALS Mäuse fast doppelt solange leben infolge der Behandlung mit bestimmten Medikamenten. Wir haben noch viel Arbeit vor uns um den Mechanismus hinter der Therapie zu entwirren. Diese Einsicht ist für die Behandlung der Erkrankung bei Patienten unabdingbar. Das benötigte Geld ist hauptsächlich beabsichtigt zum Einkauf hochtechnologischer Forschungsmaterialien (jährlich € 20 000), Mäusenkosten (jährlich € 10 000), auch zur Zahlung von Personalkosten (jährlich € 50 000). Ihre Unterstützung kann diese Forschung beschleunigen.


