Uittesten van een nieuwe behandeling in een ALS muismodel
19-07-2018

Laboratorium voor Neurobiologie
VIB – KU Leuven Center for Brain & Disease
Herestraat 49 bus 602, 3000 Leuven
Prof. Dr. Ludo Van Den Bosch
PhD student: Elisabeth Rossaert
Samenvatting van het onderzoeksproject
Om nieuwe therapeutische behandelingen te ontwikkelen die amyotrofische laterale sclerose (ALS) genezen of vertragen werd gedurende de laatste jaren intensief onderzoek uitgevoerd naar de onderliggende mechanismen die ALS veroorzaken.
Recent werd ontdekt dat transcriptie verstoord is in het ruggenmerg van patiënten. Transcriptie is het proces waarbij vanuit het genetisch materiaal (DNA) een boodschapper RNA (mRNA) wordt gevormd. Vanuit dit mRNA worden eiwitten gemaakt, die onder andere de bouwstenen vormen van elke motorische zenuwcel. Wanneer de transcriptie slecht functioneert zal dit grote gevolgen hebben voor de normale werking en dus voor de overlevingskansen van motorische zenuwcellen, die bij ALS selectief afsterven.
Het is mogelijk om de waargenomen transcriptieverstoringen te herstellen door één van de belangrijkste regulatoren van dit proces, de epigenetische merkers, te beïnvloeden. Epigenetische merkers kan men omschrijven als een “tweede laag van informatie” in en rond het DNA. Dit zijn chemische structuren die het proces van transcriptie kunnen versterken of verzwakken. Ze beïnvloeden dus de mate waarin het DNA wordt overgeschreven tot mRNA moleculen. Deze merkers kunnen rechtstreeks aangehecht zijn aan het DNA, of zich hechten aan histonen. Histonen zijn ‘verpakkingseiwitten’ die het DNA compact samenvouwen.
De epigenetische merker die relevant is voor deze studie is de acetylering van histonen. Deze merker stimuleert transcriptie. Histon-acetylasen zijn eiwitten die acetylgroepen aan histonen hechten. De afsplitsing van de acetylgroepen wordt volbracht door histon-deacetylasen (HDACs) wat een negatieve invloed heeft op transcriptie. Een medicijn dat HDACs onderdrukt zou dit laatste proces (de afsplitsting van acetylgroepen) grotendeels tegenhouden. Dit verhoogt de hoeveelheid van acetylatie en heeft zo een positief effect op transcriptie. Ze zorgt met andere woorden voor de productie van voldoende eiwitten die de cel nodig heeft om te overleven.
Het doel van deze studie is om het therapeutische potentieel van een medicijn dat HDACs onderdrukt (een HDAC inhibitor) te testen in een ALS muismodel.
Dit onderzoek vergroot ons inzicht in de rol van de epigenetische merkers op het functioneren en de overlevingskansen van motorneuronen. Daarop bouwend begrijpen we dan de effecten van specifieke medicatie die deze merkers beïnvloedt. Voor het testen van nieuwe therapeutische strategieën tegen ALS zijn deze inzichten absoluut noodzakelijk.
Waarom gebruiken we muizen als diermodel?
Het zenuwstelsel is een zeer complex orgaan. Voor dit type onderzoek blijft het daardoor essentieel dat het modelbrein lijkt op dat van een mens. De voor ALS relevante, en door de aandoening aangetaste, motorische zenuwcellen dienen bestudeerd te worden in een biologisch relevante context.
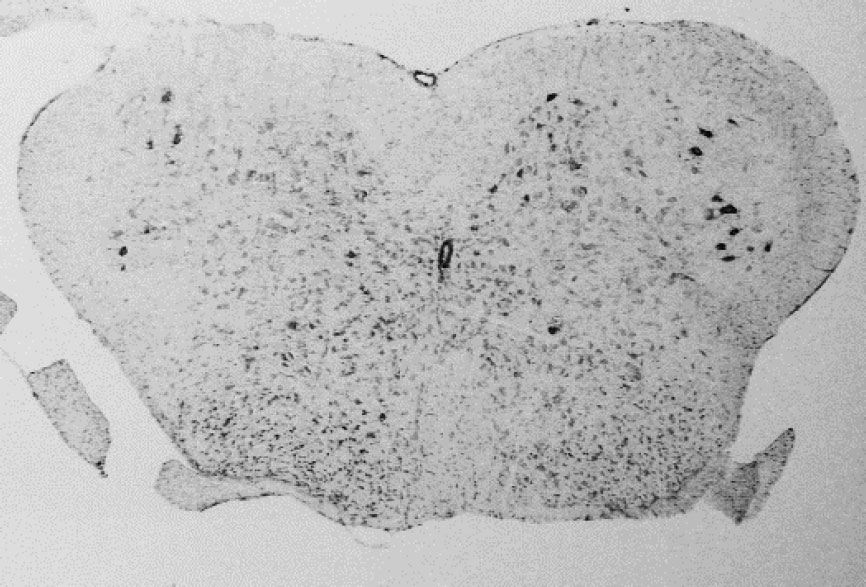 Het muismodel is op een dusdanige manier genetisch gemanipuleerd zodat het gelijkaardige pathologische kenmerken vertoont zoals bij ALS patiënten. De muizen ontwikkelen motorische problemen en sterven vroegtijdig, kort na het optreden van de eerste symptomen. Pathologisch onderzoek toonde aan dat de motorische zenuwcellen in het ruggenmerg (zie foto) van de muizen afsterven en dat hierdoor spierzwakte en verlammingsverschijnselen optreden.
Het muismodel is op een dusdanige manier genetisch gemanipuleerd zodat het gelijkaardige pathologische kenmerken vertoont zoals bij ALS patiënten. De muizen ontwikkelen motorische problemen en sterven vroegtijdig, kort na het optreden van de eerste symptomen. Pathologisch onderzoek toonde aan dat de motorische zenuwcellen in het ruggenmerg (zie foto) van de muizen afsterven en dat hierdoor spierzwakte en verlammingsverschijnselen optreden.
Door zijn sterke gelijkenissen met patiënten biedt onderzoek met de ALS muizen de unieke gelegenheid om het ziekteproces verder te bestuderen en te begrijpen. Bovendien laat het toe om nieuwe therapieën op een veilige en directe manier te testen.
Werkplan
Voor deze studie zullen ALS muizen behandeld worden met een HDAC inhibitor van zodra de eerste motorische symptomen zichtbaar worden. De muizen nemen het medicijn op via hun voeding. Daarna wordt het effect van de behandeling nagegaan door zowel de motoriek als de overleving van de muizen nauwkeurig op te volgen. Bovendien meten we de geleiding van de motorische zenuwcellen naar de spieren met een gespecialiseerde machine.
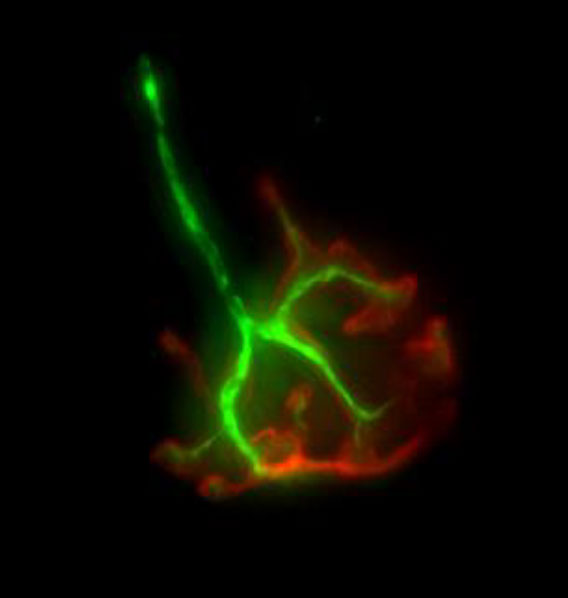 Nadien onderzoeken we het effect van de behandeling op de overleving van de motorische zenuwcellen in het ruggenmerg, alsook op de bezenuwing van de spieren (zie foto). Door weefselcoupes te kleuren wordt onder de microscoop zichtbaar of er een verbetering is bij de behandelde groep muizen. Dit wordt vergeleken met een onbehandelde controlegroep.
Nadien onderzoeken we het effect van de behandeling op de overleving van de motorische zenuwcellen in het ruggenmerg, alsook op de bezenuwing van de spieren (zie foto). Door weefselcoupes te kleuren wordt onder de microscoop zichtbaar of er een verbetering is bij de behandelde groep muizen. Dit wordt vergeleken met een onbehandelde controlegroep.
Daarnaast bestudeert dit onderzoek het effect van het geneesmiddel op de transcriptie in het ruggenmerg aan de hand van RNA-sequencing. Dit is een hoogwaardige technologie om het gehele transcriptoom in kaart te brengen. Dankzij dit onderzoek verkrijgen we nieuwe inzichten in wat er precies fout loopt tijdens het ziekteproces.
Geschatte kostprijs: € 160000 voor 2 jaar
Dit project is reeds lopende, mede dankzij de steun van de ALS Liga. We hebben kunnen aantonen dat de ALS muizen bijna dubbel zo lang leven door ze met bepaalde medicatie te behandelen. Toch wacht ons nog zeer veel werk om het mechanisme achter de therapie te ontrafelen. Voor een behandeling van de aandoening in patiënten is dit inzicht onmisbaar. Het geld dat we nodig hebben is vooral bedoeld voor de aankoop van hoogtechnologische onderzoeksmaterialen (€ 20 000 per jaar), muizenkosten (€ 10 000 per jaar), alsook om personeelskosten (€ 50 000 per jaar) te betalen. Uw steun kan dit onderzoek in een stroomversnelling brengen.


