• DAZALS n’a pas atteint son critère d’évaluation principal, à savoir une amélioration des résultats sur l’échelle d’évaluation fonctionnelle de la SLA révisée (ALSFRS-R), chez les patients ayant reçu du dazucorilant par rapport aux patients ayant reçu un placebo.
• DAZALS a atteint son critère d’évaluation secondaire, à savoir une amélioration de la survie globale à la semaine 24 de l’étude chez les patients ayant reçu 300 mg de dazucorilant par rapport aux patients ayant reçu un placebo.
• Une analyse exploratoire à un an montre une amélioration significative et continue de la survie globale entre les patients ayant reçu 300 mg de dazucorilant et ceux ayant reçu uniquement un placebo.
• Corcept sollicite l’avis des autorités réglementaires américaines et européennes sur la meilleure voie à suivre.
Corcept Therapeutics, spécialisée dans la découverte et le développement de médicaments destinés au traitement des troubles endocriniens, oncologiques, métaboliques et neurologiques sévères en modulant les effets du cortisol, a présenté les résultats de son étude DAZALS sur le dazucorilant chez les patients atteints de SLA, lors du congrès annuel 2025 du Réseau européen pour la guérison de la SLA (ENCALS). La présentation est disponible ici.
DAZALS est une étude de phase 2 randomisée, en double aveugle et contrôlée par placebo, au cours de laquelle 249 patients atteints de SLA ont été randomisés pour recevoir quotidiennement 150 mg, 300 mg ou un placebo de dazucorilant pendant 24 semaines. Les patients ayant terminé la période de traitement étaient éligibles pour participer à une étude d’extension à long terme, au cours de laquelle tous les patients ont reçu 300 mg de dazucorilant. Le critère d’évaluation principal de DAZALS était la différence de score ALSFRS-R entre les patients ayant reçu du dazucorilant et ceux ayant reçu un placebo. La survie globale était un critère d’évaluation secondaire.
Bien que DAZALS n’ait pas atteint son critère d’évaluation principal, la survie des patients s’est significativement améliorée. À la semaine 24 de l’étude, aucun décès n’était survenu parmi les 83 patients ayant reçu 300 mg de dazucorilant, tandis que cinq décès ont été recensés dans le groupe placebo (82 patients) (valeur de p : 0,02).
Une analyse exploratoire réalisée à un an montre que le bénéfice en termes de survie s’est maintenu. Les patients randomisés recevant 300 mg de dazucorilant ont connu une survie significative plus longtemps que les patients ayant reçu un placebo et n’étant pas passés à 300 mg de dazucorilant dans l’étude d’extension. La différence entre les groupes était marquée, avec un rapport de risque de 0,16 (valeur de p : 0,0009). Voir la figure 1.

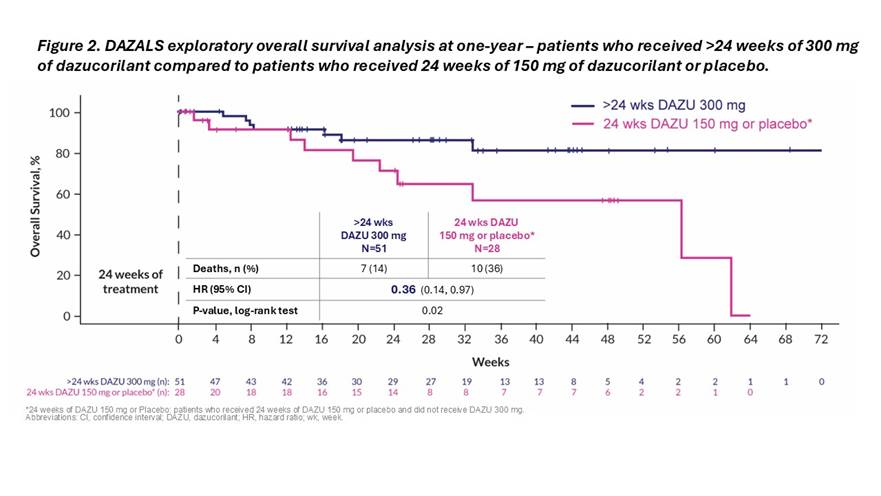
Un bénéfice de survie similaire a été observé chez les patients ayant reçu 300 mg de dazucorilant pendant plus de 24 semaines, que ce soit pendant la période de traitement ou dans l’étude d’extension, par rapport aux patients ayant reçu soit un placebo, soit 150 mg de dazucorilant pendant 24 semaines et n’ayant pas reçu de dazucorilant dans l’étude d’extension (rapport de risque : 0,36 ; valeur de p : 0,02). Voir la figure 2. L’étude d’extension est en cours.
Le dazucorilant a démontré un profil de sécurité acceptable, 92% des effets indésirables étant d’intensité légère à modérée. La fréquence des effets indésirables graves et sévères chez les patients ayant reçu du dazucorilant était similaire à celle des patients ayant reçu un placebo. Des douleurs abdominales transitoires, légères à modérées et liées à la dose, étaient l’effet indésirable le plus fréquent.
‘’L’amélioration de la survie globale, constatée pour la première fois dans l’étude DAZALS à six mois, se poursuit à un an. Ce résultat mérite toute notre attention au service des patients atteints de cette maladie tragique. Les progrès dans le développement de nouveaux traitements contre la SLA sont d’une importance cruciale’’, a déclaré Leonard H. van den Berg, M.D., Ph.D., professeur et directeur du département de neurologie de l’UMC Utrecht Brain Centre, à Utrecht, aux Pays-Bas, et chercheur principal de l’étude DAZALS.
‘’Des médicaments capables de prolonger la vie des patients atteints de SLA sont nécessaires de toute urgence. Nous collaborons avec les autorités réglementaires afin de déterminer la voie optimale pour le développement du dazucorilant’’, a déclaré Bill Guyer, PharmD, directeur du développement de Corcept. ‘’Nous tenons à remercier les patients, leurs familles et leurs proches, ainsi que les chercheurs, les médecins et le personnel soignant impliqués dans cette étude.’’
À propos de l’étude DAZALS
DAZALS est un essai de phase 2 randomisé, en double aveugle et contrôlé par placebo. 249 patients atteints de SLA ont été randomisés selon un rapport 1:1:1 pour recevoir quotidiennement 150 mg de dazucorilant, 300 mg de dazucorilant ou un placebo pendant 24 semaines. Les patients ayant terminé la période de traitement étaient éligibles pour participer à l’étude d’extension à long terme, au cours de laquelle tous les patients ont reçu 300 mg de dazucorilant. Les caractéristiques initiales des patients, notamment le score de risque ENCALS, le délai depuis le diagnostic, le score total ALSFRS-R et le début bulbaire, étaient cohérentes entre les groupes de l’étude.
Le critère d’évaluation principal de DAZALS était la différence de variation du score ALSFRS-R par rapport à la valeur initiale, pendant les 24 semaines de traitement de l’étude, entre les patients ayant reçu du dazucorilant et ceux ayant reçu un placebo. Les principaux critères d’évaluation secondaires comprenaient la survie globale et la qualité de vie. L’étude DAZALS a été menée sur des sites en Europe, aux États-Unis et au Canada.
À propos du Dazucorilant
Le Dazucorilant est un modulateur sélectif du cortisol qui se lie au récepteur des glucocorticoïdes, mais pas aux autres récepteurs hormonaux de l’organisme. Corcept l’étudie comme traitement potentiel de la SLA et d’autres troubles neurologiques. Le Dazucorilant est la propriété de Corcept et est protégé par la composition de la matière, des méthodes d’utilisation et d’autres brevets.
Traduction: Gerda Eynatten-Bové
Source: Communiqué de presse de Corcept Therapeutics

