« RNA-éponge » peut-être la cause de dégénération des neurones en cas de SLA /DLFT
11-04-2013
La cause génétique la plus courante à la fois pour la S.L.A. ((Sclérose Latérale Amyotropique ) et la DLFT(Dégénération Lobaire Fronto-temporale) est une malformation dans le gène C9orf2. Ainsi on a constaté ici dernièrement. Tout de même il reste vague comment cette mutation mène à ces maladies neurodégénératives.
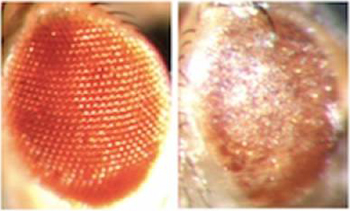 Photo: En 2011 les hommes de science ont découvert une mutation qui est la cause la plus courante de à la fois de la SLA et de la DLFT. Par cette mutation la séquence « GGGGCC » est répétée des centaines de fois sur le gène C9orf72.
Photo: En 2011 les hommes de science ont découvert une mutation qui est la cause la plus courante de à la fois de la SLA et de la DLFT. Par cette mutation la séquence « GGGGCC » est répétée des centaines de fois sur le gène C9orf72.
Comparez deux yeux de petites mouches de fruits. La mouche de droit produit du RNA nocif à base de la séquence « GGGGCC » répétée, ce qui mène à la dégénération de neurones.
Des chercheurs de l’Emory university School of Medicine ont montré que la mutation SLA-DLFT est peut-ëtre nocive parce qu’elle crée une « RNA-éponge » qui absorbe un protéine régulateur RNA-liant très important.
Mercredi les résultats ont été publiés on-line dans les Proceedings of the National Academy of Sciences, Early Edition. « Nous sommes d’avis que le RNA fait partie lui-même du mécanisme de la maladie, » ainsi le co-auteur Dr.Thomas Wingo, professeur assistant de neurologie à l’Emory University School de Medicine. « Aussi bien dans des cultures de cellules qu’avec des mouches de fruits on a pu montrer qu’on peut de nouveau compléter le protéine qui a été enlevé par le RNA et ainsi soulager le problème. »
Cette constatation éclaire le mécanisme de maladie de la SLA et la DLFT, aussi bien quand il s’agit d’une mutation C9orf72 que dans d’autres cas. Cela indique qu’il y a des analogies entre certaines formes de SLA/DLFT et d’autres troubles neurodégénératifs, qui sont causés par des séquences répétées non codant comme myotone dystrofie,spinocerebellaire ataxie et fragieleX-gerelateerde tremor/ataxiesyndroom (FXTAS)
Peng Jin est l’auteur principal de la recherche,PhD, professeur en génétique humaine à l’Emory University School of Medicine. Les premiers auteurs sont Zihui Xu, PhD, étudiant ancien de Peng Jin et associé maintenant à la Huazhong University de Science et Technologie à Chine- et le spécialiste de recherche, Mickael Poidevin
La SLA est une maladie mortelle où les neurones moteurs dans le cerveau et la moelle épinière périssent lentement. Au fur et à mesure que la maladie avance, le malade perd la possibilité de courir,de parler et de respirer. DLFT est une forme de dégénération qui attaque le comportement, la personnalité et la connaissance de la langue.
Beaucoup de neurologues et de chercheurs sont d’avis que ces deux maladies ont des analogies cliniques et pathologiques. Des mutations dans plusieurs gènes ont été mises en rapport aussi bien avec la SLA qu’avec la DLFT, ce qui peut indiquer qu’il y a lieu d’un mécanisme commun de maladie. Quand-même la plupart des cas est caractérisée comme sporadiques, ce qui signifie qu’il n’y a pas de facteurs familiales (héréditaires) clairs.
En 2011 une mutation définie C9orf72 fut identifiée qui semblait être la cause la plus courante autant pour la SLA que pour la DLFT. Pour les deux maladies cette mutation était responsable pour 5 à 7% de tous les cas de maladie.La
mutation ne semble pas influencer le protéine qui est codé par C9orf72, mais provoque une répétition multiple d’un petit bloc de DNA,de façon que la séquence « GGGGCC » est répétée des centaines de fois en dehors des parties du gène qui code le protéine.
Cela ressemble beaucoup aux séquences répétées non codant qui sont responsables pour d’autres troubles neurodégénératifs comme « myotone distrofie, spinocerebellaire ataxie en fragieleX-gerelateerde tremor/ataxiesyndroom (FXTAS).
Un nombre de chercheurs a décrit comment la séquence GGGGCC répétée reproduit du RNA qui à son tour se traduit en un protéine étrange qui s’accumule dans les cellules.
Ils sont d’avis que ces accumulations de protéine sont nocives pour les neurones.
Des chercheurs de l’Emory Université ont une autre interprétation. : le RNA qui est produit par la séquence répétée est nocif lui-même.
Le team de Emory a examiné l’effet de ce RNA dans une culture de cellules de mammifères. Ils ont constaté que le RNA nuisait les neurones. Lors des tests avec des mouches de fruits ils ont vu que le RNA menait à la dégénération de neurones. Quand on produisait du RNA dans les neurones moteurs des mouches, cela menait à une puissance moteur réduite.
Le RNA qui est produit à base de la séquence GGGGCC répétée est nocif parce en cas de surproduction il isole le protéine Pur alpha. Ce protéine se lie à la séquence GGGGCC répétée. On a constaté que la Pur alpha est nécessaire pour un bon développement des neurones et est impliqué dans le transport de RNA à l’intérieur de neurones. En laissant les neurones ou les mouches produire plus de Pur Alpha en compensation, on peut diminuer l’effet nocif. Ainsi ont trouvé les chercheurs de Emory.
Cela suggère que peut-être le SLA et le DLFT peuvent être combattus au moyen d’attaquer le RNA nocif lui-même ou d’intervenir dans l’interaction du RNA et Pur alpha », ainsi Jin. Aussi ceci semble indiquer qu’il existe un mécanisme commun relaté à l’RNA et qui attribue à l’origine de plusieurs maladies neurodégénératives.
L’isolement de Pur alpha semble mener à une autre répartition du protéine à l’intérieur des neurones de malades avec SLA et DLFT. Le team d’Emory a trouvé des coagulations avec Pur alpha dedans, dans le fibre du cerveau des gens avec des mutations C9orf72 et aussi chez d’autres DLFT malades sans mutation C9orf72.
La recherche est soutenue par National Institute for Neurological Disorders and Stroke (R01 NS051630 et R21 NS067461)et l’Atlanta Veterans Adminitration Medical Center.
Références : Z.Xu,M.Poidevin,X.Li ;Y.Li,L.shu,D.L.Nelson,H.L.M. Gearing
T.S. Wingo et P.Jin.Expanded GGGGCC repeat RNA associated with amiotrophique lateral sclerosis and frontotemporal dementia causes neurodegeneration.PNAS Early Edition (2013).
Traduction : Celestine Jans
Source : Emory University


