Immunothérapie et médecine translationnelle illustrée
29-05-2012
Introduction
Le slogan « La Science d'aujourd'hui, sont les médicaments de demain » saisit l'essence de la médecine translationnelle. La science de haute qualité est établie par les universités comme la base pour comprendre le processus de la maladie. L'industrie fournit le savoir-faire pour le développement de nouveaux médicaments, les essais cliniques et du marketing. Ensemble, dans une collaboration active entre le secteur privé et les universités, les découvertes en sciences fondamentales seront traduites plus efficacement en médicaments, changeant l’ évolution des traitements et ayant un impact sur la vie des patients.
Deux projets récents en médecine translationnelle sont présentés dans ce numéro de Neurotransmitter. La première décrit le développement d'une stratégie d'immunothérapie nouvelle pour le traitement de la sclérose latérale amyotrophique (SLA), une maladie neurodégénérative. Le deuxième exemple est pris dans le domaine des technologies de la santé et décrit le développement d'un dispositif de réadaptation robotique pour accélérer la neuroréadaptation après une lésion de la moelle épinière ou maladies comme cva du cerveau.
Ces deux projets en médecine translationnelle ont été sélectionnés et pris en charge par le conseil fédéral suisse en 2009 dans le cadre de ses mesures en stabilisation économique.
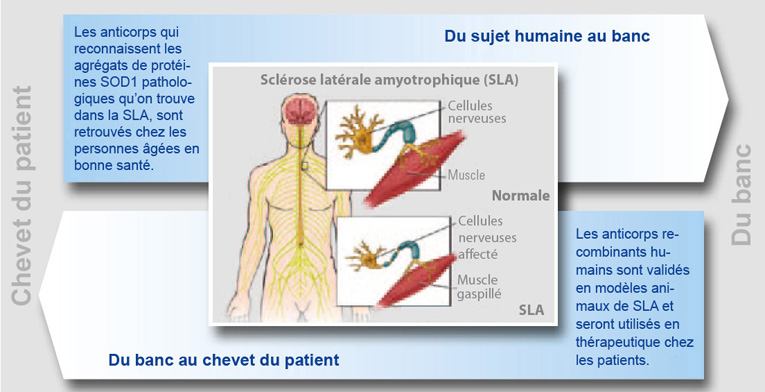
Immunothérapie en sclérose latérale amyotrophique
Un thème commun sous-jacent de nombreuses maladies neurodégénératives est le dépôt pathogène d'agrégats de protéine, dérivé normalement de protéines endogènes du cerveau. Dans la SLA, une des formes les plus graves de la dégénérescence des motoneurones, deux agrégats de protéine pathogènes, composés de la superoxyde dismutase 1 (SOD1) ou liés à la protéine TD43 (TDP-43), sont déposés dans la moelle épinière des patients. Les deux variantes, la forme génétique et la forme plus fréquente sporadique de la SLA sont associées à l'oligomérisation pathologique et dysfibrillization de SOD1 physiologique en agrégats de pathogènes. Quand ils sortent des cellules affectées, les agrégats de protéine pathogènes peuvent se lier avec leurs voisins physiologiquement homologues dans les cellules non- affectées et les forcer à adopter des conformations pathologiques.
Ce processus infectieux de type prion provoque finalement la propagation de l'agrégation des protéines de cellule à cellule et dans l'ensemble du système nerveux central. Au fil du temps, la fonction des neurones moteurs se détériore et l'état neurologique du patient diminue progressivement.
Chez des sujets humains, la formation des conformations nouvelles de protéines pathogènes peuvent s'accompagner d'une réponse immunitaire humorale, résultant dans la production de lymphocytes-B spécifiques. Ils encodent des anticorps qui, expérimentalement, peuvent se lier avec, neutraliser et éliminer des agrégats de protéine pathogènes. Ainsi, les anticorps recombinants humains, dérivés de la mémoire de la cellule-B humaine, ayant une haute affinité et une sélectivité pour les agrégés SOD1 , représentent une nouvelle classe d'anticorps thérapeutiques. Des anticorps humains ont été trouvés démontrant une liaison de haute affinité avec SOD1 dans une quantité en picomoles avec spécificité de cible élevée. L'efficacité des anticorps humains a été testée dans des modèles de souris transgéniques pour la SLA. Ces souris transgéniques expriment un SLA familial causant le transgène de SOD1 humain muté et développent des signes de la maladie du neurone moteur suivi d'une dégénérescence progressive des neurones moteurs et la mort dans les cinq à six mois. Le traitement intrathécale d'anticorps a montré des signes de sauvetage du neurone moteur, avec 70 % de plus de gros motoneurones dans la moelle épinière lombaire traitée d'anticorps par rapport aux souris transgéniques. En analyse fonctionnelle, le traitement d'anticorps retarde l'apparition des symptômes comportementaux, comme en témoignent les meilleures performances motrices et l’amélioration de l'atrophie musculaire, traduite par une diminution retardée de poids corporel. En résumé, le recombinant d’origine humaine des anticorps monoclonaux contre les agrégats de SOD1 a une efficacité in vivo à retarder, empêcher et inverser des signes de dégénérescence des motoneurones dans des modèles de souris transgéniques de la SLA.
En raison de l'origine humaine de leur ADNc, ils ont 100 % des séquences des acides aminés combinés avec l’appariement de la chaîne légère et lourde humaine naturelle et une haute affinité et sélectivité, résultant en une probabilité excellente pour la translation rapide et sécure, en clinique d’usage thérapeutique dans le traitement de la SLA chez les êtres humains.
Traduction : Ligue SLA : Anne
Source : Neurotransmitter


