CNM-Au8 dans la sclérose latérale amyotrophique
14-03-2025
L’essai plateforme HEALEY ALS
Le Comité de rédaction de l’essai plateforme HEALEY ALS ; pour le Groupe d’Etude de l'Essai Plateforme HEALEY ALS
Les Points Clés
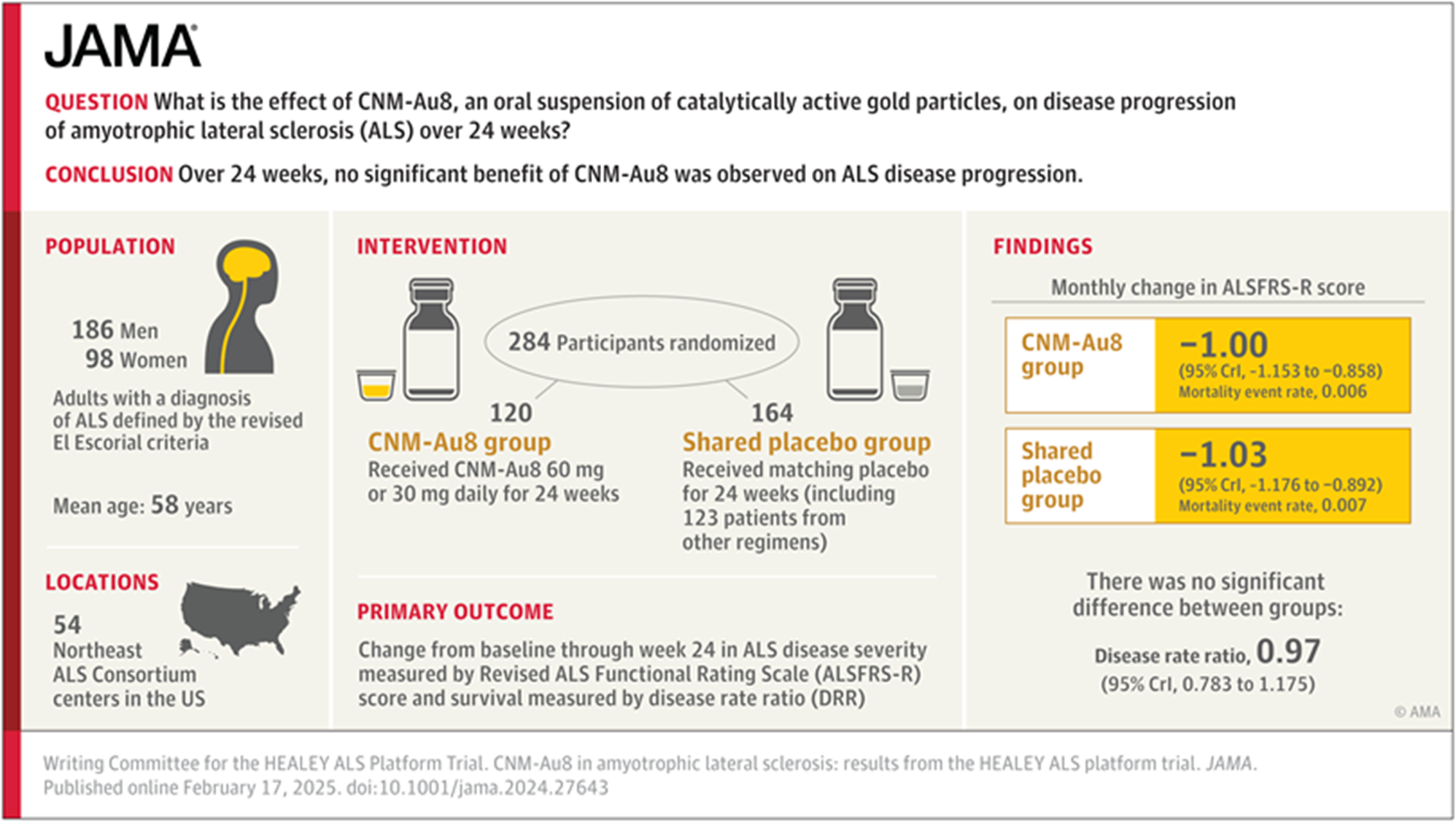
Question Quel est l'effet de CNM-Au8, une suspension orale de nanocristaux d'or catalytiquement actifs, sur la progression de la sclérose latérale amyotrophique pendant 24 semaines ?
Résultats Dans cette plate-forme d'essai randomisée testant plusieurs protocoles, un total de 161 participants a été randomisé pour recevoir le CNM-Au8 (n = 120) ou un placebo spécifique au schéma thérapeutique) (n = 41) ; les analyses ont inclus 123 participants supplémentaires sous placebo, randomisés simultanément à partir d'autres protocoles. Le ratio du taux de maladie (évaluant la progression de la maladie en tenant compte de la survie, avec <1 indiquant un ralentissement de la progression de la maladie sous CNM-Au8 par rapport au placebo) était de 0,97, ce qui suggère qu'il n'y a pas de bénéfice ou de dommage significatif du CNM-Au8 sur la progression de la maladie au cours des 24 semaines.
Signification Aucun bénéfice significatif du CNM-Au8 sur la progression de la sclérose latérale amyotrophique n'a été observé durant 24 semaines.
Résumé
Importance La défaillance bioénergétique a été proposée comme un moteur de la sclérose latérale amyotrophique (SLA). CNM-Au8 est une suspension de nanocristaux d'or qui catalyse la conversion du nicotinamide adénine dinucléotide hydride en NAD+, entraînant une augmentation de la production d'adénosine triphosphate cellulaire.
Objectif Déterminer les effets du CNM-Au8 sur la progression de la SLA.
Conception, Cadre et Participants Le CNM-Au8 a été testé comme un protocole dans le cadre de l'essai HEALEY ALS Platform Trial, un essai multicentrique, randomisé, en double aveugle de phase 2/3. L'étude a été menée dans 54 sites aux États-Unis de juillet 2020 à mars 2022 (suivi final, le 17 mars 2022). Un total de 161 participants atteints de SLA a été randomisé pour recevoir du CNM-Au8 (n = 120) ou un placebo spécifique au schéma thérapeutique (n = 41). Les données de 123 participants au placebo randomisés simultanément dans d'autres schémas thérapeutiques ont été combinées pour les analyses.
Interventions Les participants éligibles ont été randomisés selon un ratio de 3:3:2 pour recevoir 60 mg de CNM-Au8 par jour (n = 61), 30 mg de CNM-Au8 par jour (n = 59), ou un placebo correspondant (n = 41) pendant 24 semaines.
Principaux résultats et mesures Le critère principal d'efficacité était l'évolution de la sévérité de la SLA entre le début de l'étude et la semaine 24, mesurée par un modèle bayésien de fonction à paramètres partagés (basé sur l'échelle révisée d'évaluation fonctionnelle de la sclérose latérale amyotrophique) et de la survie, qui a fourni une estimation du taux de progression de la maladie mesurée par le rapport du taux de maladie (DDR ou RTM), un DDR ou RTM inférieur à 1 indiquant un bénéfice du traitement. Les critères d'évaluation secondaires comprenaient une évaluation combinée de la fonction et de la survie à l'aide d'un test de rang joint, le taux de déclin de la capacité vitale lente (pourcentage prédit) et la survie sans ventilation assistée permanente.
Résultats Parmi les 161 participants randomisés dans le protocole CNM-Au8 (âge moyen, 58,4 ans ; 61 [37,9 %] femmes), 145 (90 %) ont terminé l'essai. Dans l'analyse principale comparant les groupes de dosage combinés de CNM-Au8 aux groupes de placebo combinés, le critère d'évaluation principal (DRR, 0,97 [intervalle crédible à 95 %, 0,783-1,175] ; la probabilité postérieure de DRR <1, 0,65) et les 3 critères d'évaluation secondaires n'ont suggéré aucun bénéfice ou inconvénient du CNM-Au8. Dans les groupes actifs (n = 120) vs les groupes placebo (n = 163), les effets indésirables les plus courants étaient la diarrhée (23 [19 %] vs 12 [7 %]), les nausées (17 [14,2 %] vs 14 [8,6 %]), la fatigue (12 [10,8 %] vs 30 [18,4 %]) et la faiblesse musculaire (24 [20 %] vs 45 [27,6 %]).
Conclusions et pertinence Aucun bénéfice du CNM-Au8 sur la progression de la maladie de la SLA n'a été observé à 24 semaines.
Enregistrement de l'essai Identifiants ClinicalTrials.gov : NCT04297683, NCT04414345
Traduction: Viviane
Source: JAMA. Published online February 17, 2025


