Gebruik van nanodeeltjes om neurodegeneratieve ziekten te bestrijden
04-08-2023
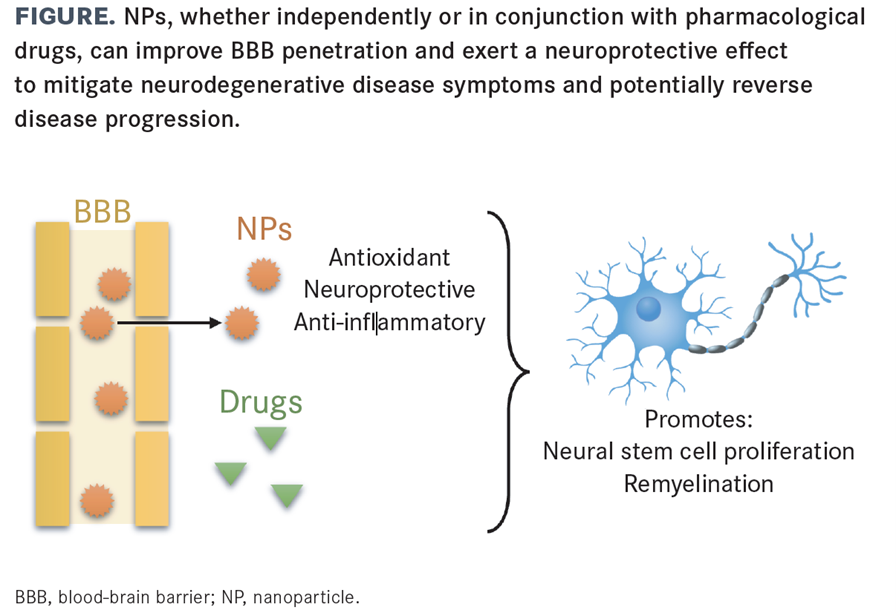
Beschikbare behandelingen voor neurodegeneratieve ziekten zijn over het algemeen onveilig en ineffectief bij het doordringen van de bloed-hersenbarrière, hoewel het gebruik van nanodeeltjes voor een betere penetratie kan zorgen en een neuroprotectief effect kan hebben.
Neurologische aandoeningen, met inbegrip van neurodegeneratieve ziekten, hebben aanzienlijke sociale en economische gevolgen voor de miljoenen mensen die er wereldwijd door worden getroffen en de verwachting is dat het aantal gevallen de komende 30 jaar zal toenemen. Neurodegeneratieve ziekten worden gekenmerkt door een progressieve neuronale afsterving in het centrale (CZS) en perifere (PZS) zenuwstelsel, wat leidt tot invaliderende beperkingen van de motorische en cognitieve functies. Neurodegeneratieve ziekten kunnen worden veroorzaakt door neurotoxische gebeurtenissen die resulteren in een ontregeld energiemetabolisme, uitgebreid neuronaal verlies, synaptische afwijkingen en afwijkende eiwitaccumulatie.
Therapeutica voor neurodegeneratieve ziekten vereisen een optimale farmacokinetische distributie van geneesmiddelen door het CZS, met minimale systemische bijwerkingen (bijv. motorische complicaties). Vanwege de complexe pathofysiologie van neurodegeneratieve ziekten ontbreken gerichte farmacologische benaderingen. Veel neurodegeneratieve ziekten hebben kenmerken gemeen van energietekort, mitochondriale disfunctie en metabole stress voordat de klinische symptomen optreden. Neuroinflammatie als gevolg van microglia- en axoglia-activatie en de afscheiding van pro-inflammatoire mediatoren is ook een gemeenschappelijk kenmerk van neurodegeneratieve ziekten; neuroinflammatie zou dus een nieuw doelwit voor therapeutische interventie kunnen zijn. Bovendien zijn de beschikbare behandelingen voor neurodegeneratieve ziekten over het algemeen onveilig en niet effectief bij het doordringen van de bloed-hersenbarrière (BBB), en bieden ze alleen symptomatische verlichting. Hier kan het gebruik van nanodeeltjes (NP's) zorgen voor een betere BBB-penetratie en een neuroprotectief effect hebben.
NP's zijn zeer kleine (1-1000 nm) deeltjes die bestaan uit organische (d.w.z. lipiden, nano-emulsies en polymeren) of anorganische (d.w.z. Au, goud; TiO2, titaniumdioxide; IO, ijzeroxide; en andere metalen) materialen, eiwitten en polysacchariden. NP-systemen zijn om verschillende redenen gunstig (zie FIGUUR): NP's vernietigen ontstekingsmoleculen zonder nadelige gevolgen voor normale cellen; metaalnp's katalyseren reductie-oxidatiereacties (redox) om cellulaire oxidatieve stress tegen te gaan; NP's schermen geneesmiddelen af om de lipofiele vereiste om de BBB te passeren te overwinnen; NP's verbeteren de stabiliteit van geneesmiddelen en veranderen het patroon voor het vrijgeven van geneesmiddelen, waardoor de biologische beschikbaarheid toeneemt en de vereiste therapeutische dosis afneemt; NP's kunnen worden aangepast voor celspecifieke en selectieve doelgerichtheid (bijv. gericht op de hersenen); en NP's kunnen worden afgestemd op de ziekte en de behoeften van patiënten. Ondanks de krachtige neuroprotectieve en ontstekingsremmende effecten van NP's zijn sommige NP's in verband gebracht met schadelijke neurotoxiciteit en ontstekingsbevorderende reacties.
Het ontwerp van NP is van invloed op de compatibiliteit met latere toepassingen. De vorm van NP's draagt bij aan biologische functies zoals medicijnafgifte, halfwaardetijd, endotheliale opname en doelgerichtheid. Kleine NP's zorgen voor een snellere afgifte van geneesmiddelen vanwege hun grote oppervlakte-volumeverhouding, terwijl grote NP's zorgen voor een langzamere afgifte van geneesmiddelen vanwege de snellere afbraak van polymeren. De oppervlaktelading en hydrofobiciteit van NP's beïnvloeden de NP-biodistributie, circulatietijd en toxiciteit. Positief geladen NP's verbeteren de beeldvorming, genoverdracht en medicijnafgifte, maar vertonen een hogere cytotoxiciteit.
Vanwege hun biocompatibiliteit en instelbare grootte zijn gouden NP's (AuNP's) ideale kandidaten voor het toedienen van grote hoeveelheden antibiotica. De vorm, grootte en oppervlakte-eigenschappen van AuNP's moduleren hun interacties met cellen. Wanneer AuNP's zichzelf assembleren, worden functionele groepen blootgesteld aan het oppervlak, waardoor de activiteit van de functionele groepen zelf aanzienlijk toeneemt. In het bijzonder katalyseert oppervlaktegebonden zuurstof de oxidatiereactie van nicotinamide adenine dinucleotide (NADH) tot de kritieke energetische cofactor NAD+. NADH-oxidatie stuurt cellulaire ademhalings- en stofwisselingsprocessen aan die het myelinisatieproces aandrijven. AuNP's kunnen dus een remyeliniserende therapie ondersteunen om functies te herstellen die werden aangetast door neurodegeneratieve ziekteactiviteit, waardoor de levenskwaliteit van patiënten verbetert en mogelijk de progressie van de ziekte omkeert. AuNP's kunnen ook de toediening van medicijnen transformeren ten gunste van neurale celversterking; AuNP's hebben bijvoorbeeld de cognitieve en antioxidantfunctie verbeterd in modellen voor de ziekte van Alzheimer. AuNP's in combinatie met stamceltherapie verbeteren verder de celspecifieke targeting en de bevordering van zelfvernieuwing, proliferatie en differentiatie van endogene en exogene neurale stamcellen.
CNM-Au8 (Clene Nanomedicine Inc) is een orale AuNP-suspensie die NAD+ en NADH gebruikt om redoxreacties aan te sturen, cellen te beschermen tegen reactieve zuurstofspecies en tegelijkertijd de myeline productie te verbeteren. CNM-Au8 is ontworpen om hersencellen te helpen hun energiereserves te verhogen en stressbestendigheid te verhogen. Aangezien het werkingsmechanisme van CNM-Au8 niet beperkt is tot één eiwitdoel of celtype, is CNM-Au8 een potentieel breed neurotherapeuticum dat neurodegeneratieve ziekte-gestoorde cellulaire bio-energetica kan redden. Au@PEG3SA, een ander AuNP, werd onlangs gesynthetiseerd met behulp van een nieuwe laag-voor-laag benadering van zelf-assemblage die resulteerde in een zeer efficiënte oppervlakte-gefunctionaliseerde AuNP met verbeterde kinetiek in vivo.
CNM-Au8 heeft deelgenomen aan klinische onderzoeken voor neurodegeneratieve ziekten, waaronder multiple sclerose (MS) en amyotrofe laterale sclerose (ALS). Hiervan is VISIONMS-LTE (NCT04626921) een open-label, lange termijn uitbreidingsstudie beschikbaar voor deelnemers die VISIONARY-MS (NCT03536559) hebben voltooid, een gerandomiseerde, dubbelblinde, parallelle groep, placebogecontroleerde studie voor de behandeling van visuele paddefecten bij patiënten met stabiele relapsing multiple sclerose (RMS), hoewel deze werd beëindigd vanwege COVID-19 veranderingen. Deelnemers aan VISIONMS-LTE ontvingen een dagelijkse dosis van 30 mg CNM-Au8, met latere aanpassingen van de individuele dosering op basis van de resultaten van VISIONARY-MS. Het primaire eindpunt is het beoordelen van de werkzaamheid en veiligheid van CNM-Au8 als remyeliniserende therapie bij RMS. De resultaten worden eind 2024 verwacht.
RESCUE-ALS (NCT04098406), een multicenter, gerandomiseerde, dubbelblinde, parallelle groep, placebogecontroleerde studie, beoordeelde de werkzaamheid, veiligheid, farmacokinetiek en farmacodynamiek van CNM-Au8 bij patiënten met amyotrofische laterale sclerose (ALS). RESCUE-ALS gebruikte elektromyografie om het verlies van motorneuronen (motor unit number index), de gezondheid van de longen (geforceerde vitale capaciteit) en reïnnervatie (motor unit size index) te controleren. Ondanks het falen van deze primaire en secundaire doelen, toonde CNM-Au8 zich veelbelovend in het vertragen van de ziekteprogressie en het verbeteren van de overleving op lange termijn. In juli 2022 kreeg CNM-Au8 van het Comité voor weesgeneesmiddelen van het Europees Geneesmiddelenbureau het predikaat weesgeneesmiddel voor de behandeling van ALS. CNM-Au8 wordt nog steeds onderzocht in de multiregimen HEALEY ALS Platform studie (NCT04297683), een doorlopend multicenter klinisch onderzoek waarin de veiligheid en werkzaamheid van onderzoeksproducten, gelijktijdig of sequentieel toegediend, voor ALS worden geëvalueerd. De resultaten worden eind 2022 verwacht.
Effectieve therapieën zijn essentieel voor de behandeling en preventie van neurodegeneratieve ziekten. NP's zouden de behandeling van neurodegeneratieve ziekten kunnen veranderen door fysiologische reacties te stimuleren met minimale bijwerkingen. Aangezien neurodegeneratieve ziektemechanismen complex en veelzijdig zijn, zouden combinatorische therapieën effectiever kunnen zijn. In dit opzicht zijn AuNP's zeer compatibel met farmacologische geneesmiddelen, zodat AuNP's de schadelijke effecten van geneesmiddelen kunnen verminderen, hun heilzame effecten kunnen vergroten en hun werkzaamheid kunnen verlengen.
Vertaling: E. Van Daele
Bron: NeurologyLive


