Onderzoekers van de Universiteit van Tel Aviv hebben het biologisch mechanisme geïdentificeerd dat zenuwvernietiging veroorzaakt bij de motor-neuronziekte ALS
07-02-2022
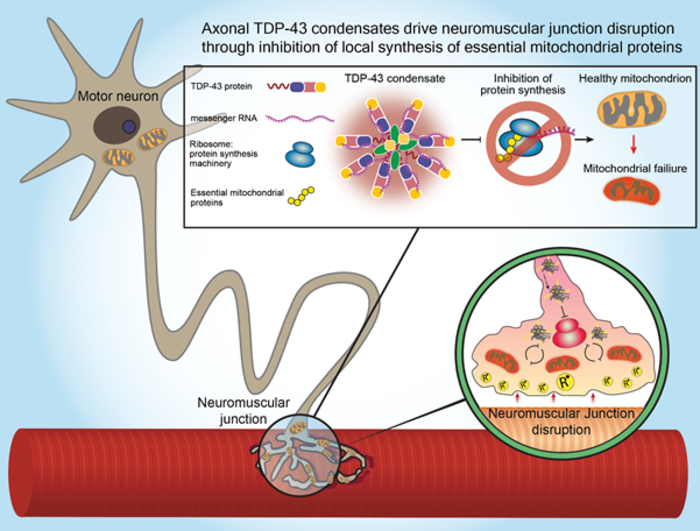
AFBEELDING: EEN ILLUSTRATIE DIE DE TDP-43 PROTEINE TOONT DIE DESTRUCTIEF ACCUMULEERT IN MOTORISCHE ZENUWUITEINDEN, MET NAME IN DE NEUROMUSCULAIRE VERBINDINGEN VAN ALS-PATIENTEN, WAAR HET BOODSCHAPPER RNA MOLECULEN VASTHOUDT EN DE SYNTHESE VAN PROTEINEN DIE ESSENTIEEL ZIJN VOOR DE MITOCHONDRIALE FUNCTIE VERHINDERT.
Een onderzoeksgroep van de Sackler Faculteit Geneeskunde en de Sagol School van Neurowetenschappen aan de Universiteit van Tel Aviv heeft voor het eerst het biologische mechanisme ontdekt dat zenuwvernietiging veroorzaakt bij de neurodegeneratieve ziekte ALS. De baanbrekende studie, geleid door Prof. Eran Perlson en de doctoraatsstudenten Topaz Altman en Ariel Ionescu, suggereert dat het verloop van deze fatale ziekte kan vertraagd worden en zelfs omgekeerd in de vroege stadia. De studie werd uitgevoerd in samenwerking met Dr. Amir Dori, directeur van de kliniek voor neuromusculaire ziekten in het Medisch Centrum Sheba. De resultaten van de studie werden gepubliceerd in het toonaangevende tijdschrift Nature Communication.
ALS is de meest voorkomende vorm van motorneuronziekte, die verlamming en spieratrofie veroorzaakt. Eén op 400 mensen zal de ziekte krijgen, en toch is er geen efficiënte behandeling. ALS-patiënten verliezen geleidelijk hun vermogen om hun vrijwillige spierbewegingen te controleren, wat leidt tot volledige verlamming en uiteindelijk verliezen ze de mogelijkheid om zelfstandig te ademen. De gemiddelde levensverwachting van ALS-patiënten is momenteel slechts ongeveer drie jaar.
"Tot op de dag van vandaag is het onduidelijk wat de ziekte veroorzaakt", legt Prof. Perlson uit. "Slechts ongeveer 10% van de patiënten hebben een familiale achtergrond met gekende genetische mutaties, maar de overige 90% zijn een mysterie. De verlamming veroorzaakt door de ziekte komt van schade aan de motorneuronen, wat leidt tot de aftakeling van zenuwuiteinden en het verlies van spierbezenuwing. Dit leidt bijgevolg tot de aftakeling van de zenuw en de dood van motorneuronen in de ruggegraat, maar tot nu konden we het fundamentele biologische mechanisme dat de initiële schade achter deze vicieuze waterval veroorzaakt niet begrijpen ".
Om het mysterie op te lossen, concentreerden de onderzoekers van de Universiteit van Tel Aviv zich op een eiwit genaamd TDP-43, waarvan in eerdere studies was aangetoond dat het zich in ongebruikelijke aantallen en op een ongebruikelijke plaats accumuleert in de hersenen van ongeveer 95% van alle ALS-patiënten. Prof. Perlson en zijn team legden een nieuwsoortige biologische link bloot tussen de accumulatie van het eiwit en de aftakeling van de synapsen tussen de uiteinden van de motorneuronen en de spieren, neuromusculaire kruispunten genoemd, die neurale commando’s vertalen in fysieke bewegingen. In spierbiopsies afgenomen bij ALS-patiënten vonden de onderzoekers dat het giftige eiwit ook accumuleert in grote nabijheid tot deze neuromusculaire kruispunten tijdens de vroege stadia van de ziekte en vóór de patiënten enige serieuze symptomen ontwikkelen. In een serie experimenten uitgevoerd door de onderzoekers, zowel in cellen van ALS-patiënten als in genetisch gemodificeerde modeldieren, ontdekten ze dat de ophoping van het TDP-43 eiwit in het neuromusculaire kruispunt de mogelijkheid verhindert om plaatselijk eiwitten samen te voegen die essentieel zijn voor mitochondriale activiteit, dat de kracht levert voor fundamentele cellulaire processen. De disfunctie van mitochondria in zenuwuiteinden leidt tot verstoring van het neuromusculaire kruispunt en uiteindelijk tot de dood van motorneuronen. "Het is belangrijk om eerst de ruimtelijke complexiteit van motorneuronen te begrijpen, zegt Prof. Perlson.
" De motorneuronen bevinden zich in het ruggenmerg en moeten elke spier in het lichaam bereiken om deze te kunnen bedienen. Je kunt je bijvoorbeeld voorstellen dat een verlengsnoer uit het ruggenmerg komt en de spieren in de kleine teen van onze voet bereikt. Deze uitlopers kunnen bij volwassenen tot een meter lang zijn en worden axonen genoemd. In eerdere studies hebben wij aangetoond dat om deze complexe organisatie in stand te houden de axonen van motorneuronen een verhoogde hoeveelheid energie nodig hebben, vooral in de meest afgelegen delen, de neuromusculaire knooppunten. In onze huidige studie richtten wij ons op een pathologische verandering in het TDP-43 eiwit dat plaatsvindt in deze axonen en bij neuromusculaire knooppunten. In een normaal motor neuron, wordt dit eiwit voornamelijk gevonden in de kern. Wij toonden aan dat bij ALS dit eiwit de celkern verlaat en zich in de gehele cel en met name in het neuromusculaire knooppunt ophoopt. Aangezien de functie van motorneuronen afhangt van deze neuromusculaire verbindingen die zich aan het uiteinde van de "verlengkabel" bevinden, beseften wij dat deze bevinding van cruciaal belang kon zijn. Wij ontdekten dat de ophopingen gevormd door het TDP-43 eiwit in neuromusculaire knooppunten RNA moleculen insluiten en de synthese van essentiële eiwitten voor de mitochondriale functie verhinderen. Mitochondriën zijn organellen in cellen en zijn de voornaamste energieleveranciers voor talrijke cellulaire processen, waaronder neurale overdracht. De condensatie van TDP-43-eiwit in neuromusculaire knooppunten leidt tot een ernstige uitputting van energie, verhindert mitochondriaal herstel, en leidt bijgevolg tot de ontwrichting van deze knooppunten, degeneratie van de gehele "verlengkabel" en tot de dood van motorneuronen in het ruggenmerg.”
Om hun bevindingen te bevestigen, besloten de onderzoekers van de Universiteit van Tel Aviv gebruik te maken van een experimentele molecule die onlangs door een groep onderzoekers uit de VS werd gepubliceerd en voor een ander doel werd ontwikkeld - de neurale regeneratie na verwonding verbeteren door de ontmanteling van eiwitcondensaten in neurale uitbreidingen. De onderzoekers toonden aan dat deze molecule ook de axonale TDP-43 eiwitcondensaten kon ontmantelen in cellen van ALS patiënten, en dat dit proces het vermogen om essentiële eiwitten te produceren verbeterde, de mitochondriale activiteit verhoogde, en de degeneratie van de neuromusculaire verbinding voorkwam. Bovendien toonden de onderzoekers in de modeldieren aan dat door het omkeren van TDP-43 accumulatie in zenuwen en neuromusculaire knooppunten herstel van gedegenereerde neuromusculaire knooppunten mogelijk werd - en dat de zieke modeldieren bijna volledig konden rehabiliteren.
"Op het moment dat we de ontmanteling van TDP-43 eiwitcondensaten induceerden, werd het vermogen van de zenuwen om eiwitten te produceren hersteld, in het bijzonder de synthese van eiwitten die essentieel zijn voor mitochondriale activiteit. Dit alles maakte het mogelijk voor de zenuwen om te regenereren", vat Prof. Perlson samen. "We hebben zowel met farmacologische als genetische middelen kunnen aantonen dat motorische zenuwen kunnen regenereren - en dat patiënten hoop kunnen hebben. In feite hebben we het basismechanisme gelokaliseerd, evenals de proteïnen die verantwoordelijk zijn voor de onderbreking van de zenuwen van de spieren en voor hun degeneratie. Deze ontdekking kan leiden tot de ontwikkeling van nieuwe therapieën die de TDP-43 eiwitcondensaten kunnen oplossen of de productie van eiwitten die essentieel zijn voor de mitochondriale functie kunnen verhogen, en zo de zenuwcellen kunnen genezen voordat de onomkeerbare schade die in het ruggenmerg optreedt, zich voordoet. We pakken het probleem aan de andere kant aan - in de neuromusculaire verbinding. En als we in de toekomst vroeg genoeg kunnen diagnosticeren en ingrijpen, is het misschien mogelijk om de destructieve degeneratie in de spieren van ALS-patiënten af te remmen."
De studie is een internationale samenwerking met vooraanstaande wetenschappers uit Duitsland, Frankrijk, Engeland en de VS, met de hulp van Tal Gardus Perry en Amjad Ibraheem uit het laboratorium van Prof. Perlson.
VERTALING: E. VAN DAELE
BRON: PRESS RELEASE EUREKALERT
TIJDSCHRIFT: Nature


