Wetenschappers creëren proteïne 'zaden' die belangrijke pathologische kenmerken van ALS en frontotemporale dementie activeren
02-04-2025
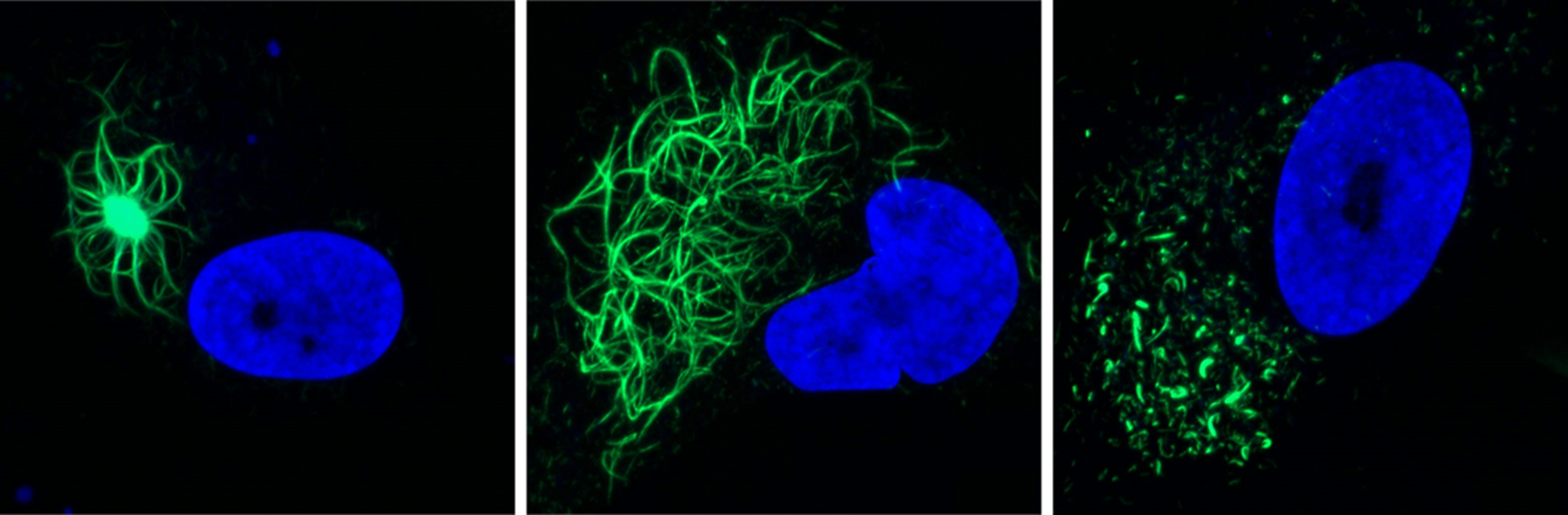
Drie soorten aggregaten (groen gekleurd): gecompacteerde aggregaten die een dichte kern in het midden bevatten (links),
aggregaten die zich voordoen als een netwerk van filamenten (midden) en fragmentaggregaten. De kern is blauw gekleurd.
Accumulatie van een proteïne genaamd TDP-43 is een belangrijk kenmerk van ALS en frontotemporale dementie. In een onlangs gepubliceerde studie rapporteren onderzoekers dat ze deze accumulatie 'zaaien' via fragmenten van het schuldige proteïne dat in het lab is gecreëerd. De bevindingen leveren verder bewijs voor een prionachtig paradigma waarin proteïne-aggregatie op een template-manier plaatsvindt. Deze doorbraak biedt het onderzoeksveld een krachtige manier om de mechanismen die neurodegeneratie aansturen te modelleren en te bestuderen.
TAR DNA-bindend proteïne 43, beter bekend als TDP-43, is een proteïne dat in bijna alle menselijke cellen voorkomt, waar het een essentiële rol speelt bij het reguleren van genexpressie, RNA-verwerking en cellulaire stressreacties. Onder normale omstandigheden helpt TDP-43 de gezondheid en functie van neuronen te behouden door te bepalen welke genen aan of uit worden gezet en hoe hun berichten worden vertaald in eiwitten.
TDP-43 is echter berucht om zijn rol bij verschillende neurodegeneratieve ziekten, waaronder ALS en frontotemporale dementie, maar ook de ziekte van Alzheimer.
Van de kern naar het cytoplasma
"TDP-43-pathologie wordt beschouwd als een bepalend kenmerk in bijna alle ALS-gevallen en ongeveer de helft van de gevallen van frontotemporale dementie", legt professor Sandrine Da Cruz uit, groepsleider bij het VIB-KU Leuven Center for Brain & Disease Research. "In de hersenen van deze patiënten verplaatst TDP-43 zich op de een of andere manier, hoopt het zich op in het cytoplasma waar het onoplosbare insluitsels vormt en wordt het uit de kern verwijderd."
Ondanks zijn cruciale rol blijven de exacte processen die de disfunctie van TDP-43 aansturen slecht begrepen - een urgente leemte die onderzoekers als Da Cruz actief proberen te vullen. De verwoesting en wijdverbreide neuronale dood die volgt na TDP-43-mislokalisatie is hoogstwaarschijnlijk te wijten aan een combinatie van zowel verstoring van de normale activiteiten van TDP-43 in de kern als het toxische effect van de cytoplasmatische insluitsels.
"Een deel van de reden waarom de onderliggende mechanismen nog steeds slecht worden begrepen, is dat we modelsystemen missen die zowel de nucleaire uitputting van TDP-43 als de cytoplasmatische aggregatie ervan betrouwbaar recapituleren", zegt Da Cruz.
Zaden voor aggregatie
Voortbouwend op recente rapporten dat autopsie van hersenmateriaal van patiënten met TDP-43-insluitsels de accumulatie van onoplosbaar TDP-43 in cellen en transgene muismodellen kan veroorzaken, zochten Da Cruz en haar team naar een manier om deze zogenaamde aggregatie 'seeding' in het lab te reproduceren.
In een recent gepubliceerd onderzoek in Neuron beschrijft het team van Da Cruz hoe ze amyloïde-achtige fibrillen produceerden uit een fragment van TDP-43 en dat deze fibrillen TDP-43-pathologie in menselijke cellen, waaronder van iPSC afgeleide neuronen, veroorzaken.
De door fibrillen geïnduceerde insluitsels herhalen veel van de belangrijkste kenmerken die we bij patiënten zien, legt promovendus Jens Rummens uit: "De door de fibrillen geïnduceerde TDP-43-aggregaten vertoonden veel van de modificaties die we ook in de hersenen van patiënten zien, waaronder fosforylering en ubiquitinatie. Opvallend genoeg waren de aggregaten in staat om endogene TDP-43 van de kern naar het cytoplasma te rekruteren."
De overeenkomsten strekten zich uit tot andere downstream-effecten, aangezien het team kenmerkende genactiviteitspatronen identificeerde die eerder waren gekoppeld aan zowel aggregatie als nucleair verlies van TDP-43. De aggregaten zelf vertoonden dezelfde heterogeniteit in morfologie als doorgaans wordt gezien bij patiënten in de loop van de tijd.
Hulpmiddel voor onderzoek
De nieuwe resultaten suggereren sterk dat pathologie in TDP-43-proteïnopathieën zich op een zelf-templating en prion-achtige manier voortplant, maar er blijven veel vragen onbeantwoord. Hoe wordt TDP-43 'gevangen in de aggregaten'? Waaruit bestaan ze en hoe veroorzaken ze toxiciteit? Welke extra 'hits' zijn vereist? Wat zijn de effecten van TDP-43-mutaties? Van leeftijd?
Dus misschien wel het belangrijkste is dat de nieuwe studie wetenschappers de daadwerkelijke hulpmiddelen biedt om de verschillende triggers en complexe interactie in een gecontroleerd systeem te bestuderen.
Da Cruz: "We hebben een waardevol model ontwikkeld dat beide aspecten van TDP-43-pathologie weergeeft: cytoplasmatische aggregatie en nucleaire uitputting. Dit zal een krachtig hulpmiddel zijn om onderzoekers over de hele wereld te helpen de door TDP-43 geïnduceerde ziektemechanismen verder te ontrafelen en ons in staat te stellen potentiële medicijnkandidaten te screenen die de ziekteprogressie modificeren."
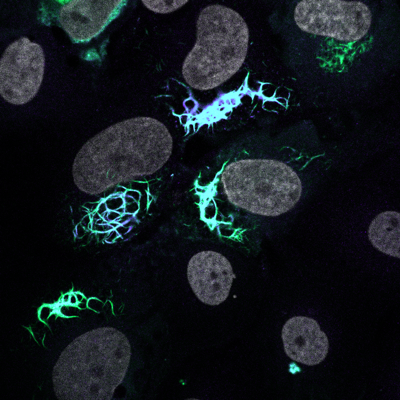
TDP-43 aggregaten (groen/blauw) en kernen (grijs)
TDP-43 seeding induceert cytoplasmatische aggregatie heterogeniteit en nucleair verlies van functie van TDP-43
Rummens et al. Neuron 2025
Dit onderzoek was een samenwerking tussen verschillende labs van VIB, KU Leuven en UHasselt, mogelijk gemaakt door extra financiële steun van FWO, de Muscular Dystrophy Association en de Alzheimer Research Foundation.
Vertaling: Gerda Eynatten-Bové
Bron: Website VIB


