Brainstorm annonce des résultats positifs de l’étude américaine Phase 2 NurOwn® chez des Patients atteints de sclérose latérale amyotrophique (SLA)
18-07-2016
NurOwn® a été démontré étant sûr et bien toléré
Avantage cliniquement significative démontré par une réponse supérieure de NurOwn® par rapport au Placebo à tous moments mesurés
conférence et diffusion par à 10:00am
HACKENSACK, New Jersey et PETACH Tikva, Israël, PRNewswire /--BrainStorm Cell Therapeutics Inc., un développeur de premier plan de cellules souches adultes thérapeutiques pour les maladies neurodégénératives, a annoncé aujourd'hui des résultats provenant d’une étude de phase 2 aux États-Unis récemment achevée, randomisée, en double-aveugle, contrôlée contre placebo de NurOwn® chez des Patients atteints de SLA. L’étude a atteint son objectif principal, en démontrant que NurOwn était sûr et bien toléré. NurOwn a également atteint plusieurs paramètres secondaires d’efficacité, montrant clairement un avantage cliniquement significatif. Les taux de réponse étaient notamment plus élevés pour les sujets traités avec NurOwn par rapport au placebo à tous moments mesurés dans l’étude durant 24 semaines.

« Nous sommes très encouragés par ces résultats de Phase 2 qui montrent que la thérapie cellulaire NurOwn est sans danger et qu’une seule administration produit une réaction bénéfique transitoire et cliniquement significative en ce qui concerne les deux paramètres l’ALS-FRS-R rating scale et les biomarqueurs du CSF(liquide céphalo-rachidien), » dit Dr. Robert H. Brown, professeur et chef de neurologie à l’Université de Massachusetts Medical Center et de Medical School et investigateur d’étude. « Ces découvertes passionnantes indiquent clairement qu’il convient de mener une étude plus longue avec dosage répétitif. »
« Nous sommes enthousiasmés par les résultats de l’étude qui fournissent des informations importantes sur l’innocuité, l’efficacité préliminaire et les effets biologiques de NurOwn, », a déclaré Merit E. Cudkowicz, M.D., M.SC., professeur de neurologie à Harvard Medical School et chef de la neurologie au Massachusetts General Hospital. « Il y a plus de participants dans le groupe traité qui ont eu un ralentissement de la progression et il n’y a aucun problème de sécurité. L’augmentation des niveaux de facteurs de croissance dans le liquide céphalo-rachidien et une diminution des marqueurs inflammatoires observés après deux semaines sont une preuve encourageante pour un effet biologique. Selon ces résultats, répéter un dosage à 8 à 12 semaines et faire un essai de confirmation plus grand est avisé. J’ai hâte de continuer à travailler en étroite collaboration avec Brainstorm sur le développement de NurOwn pour la SLA. »
« Après près de trente ans d’études cliniques en SLA je suis personnellement très encouragé et enthousiasmé par les résultats de l’étude. » a déclaré Anthony J. Windebank M.D, professeur de neurologie et directeur du département de découverte, Mayo Clinic Center for Regenerative Medicine. « Il y a des signaux positives pour l’efficacité avec des indications claires pour passer à la phase suivante. Nous ici de la clinique Mayo sont désireux d’aller de l’avant ainsi dès que possible. »
« les patients dans l’étude de Brainstorm ont toléré le traitement extrêmement bien et il n’y avait aucun événement indésirable grave lié au traitement. Le profil d’innocuité offre certainement la possibilité de continuer à examiner cette approche de traitement en SLA. », a déclaré Carlayne E. Jackson, MD, FAAN, professeur de neurologie et oto-rhino-laryngologie, Chief Medical Officer - UT médecine San Antonio, University of Texas Health Science Center, qui est présidente du Data Safety Monitoring Board de cette étude.
« Je tiens à remercier les patients qui ont participé à cet essai clinique, mais aussi les investigateurs, les membres du DSMB et tous ceux qui ont contribué à la réussite de cet essai. Ces données nous donnent des renseignements précieux sur l’effet du traitement salutaire avec NurOwn », a déclaré Chaim Lebovits, CEO de Brainstorm. « Cette étude a atteint ses objectifs, ce qui démontre sa capacité à fournir et des avantages cliniques aux patients SLA et la sécurité de NurOwn et, plus important encore, nous aidera à déterminer la population d’étude et la conception d’une étude pivotale avec des doses multiples de NurOwn dans la SLA. »
Plan d’étude
L’étude de Phase 2 était une étude multicentrique randomisée, en double-aveugle, contrôlée contre placebo visant à évaluer l’innocuité et l’efficacité de NurOwn chez 48 patients SLA. Elle a été menée dans trois centres aux États-Unis : Massachusetts General Hospital, UMass Medical School et la clinique Mayo. Les patients ont été randomisés pour recevoir les NurOwn cellules administrées combinant injection intramusculaire et intra thécale (n = 36), ou un placebo (n = 12). Tous les mois, ils ont été suivis pendant environ trois mois avant le traitement et six mois après le traitement, et évalués à 2, 4, 8, 12, 16 et 24 semaines. L’objectif principal de l’étude était l’innocuité et la tolérabilité. Les analyses d’efficacité pré-spécifiés étaient : le changement dans la pente du score de l’échelle de cotation fonctionnelle de la sclérose latérale amyotrophique (ALSFRS-R), le changement dans la capacité vitale lente (SVC) et la force musculaire, l’analyse des répondeurs (le pourcentage de sujets ayant amélioré après le traitement par rapport à la période avant le traitement) et une analyse de sous-groupes sauf des patients avec la progression lente qui sont moins susceptibles d’avoir un avantage détectable de NurOwn. Compte tenu de la nature exploratoire de cette étude, une signification statistique a été définie comme une valeur p unilatérale < 0,1 à l’aide du test exact de Fisher.
ALSFRS-R analyse des répondeurs de la population avec l’intention de traiter
L’analyse pré-spécifiée des répondeurs examine le pourcentage des améliorations et les améliorations en absolu, par mois, après le traitement, de la pente de l’ALSFRS-R par rapport à la pente avant le traitement. Le premier a analysé des patients ayant obtenu une amélioration de 25 %, 50 %, 75 % et 100 %. Les neurologues considèrent une amélioration de 25 % de la pente comme au moins un peu cliniquement significative et une amélioration de 50 % de la pente comme très cliniquement significative (Castrillo-Viguera et al, sclérose latérale amyotrophique 2010 ; 11 : 178_180)2.
Dans l’ensemble de toute définition de « répondeur » et à tout moment étudié-sauf un- un pourcentage plus élevé de sujets traités par NurOwn étaient répondeurs par rapport au placebo. À titre d’exemple, à la semaine 12 (après traitement), 40 % des sujets dans le groupe NurOwn, contre seulement 17 % des sujets sous placebo, a connu une amélioration d’au moins 50 % de la pente ALSFRS-R après le traitement par rapport à avant le traitement.
Le tableau ci-dessous montre les bénéfices chez les patients NurOwn traités ; les répondeurs ont été définis en utilisant un seuil très élevé de 100 % d’amélioration de la pente après le traitement par rapport à la pente avant le traitement, ce qui signifie qu’un sujet devait avoir une stabilisation de la maladie ou une amélioration pour être défini comme répondeur. Le tableau ci-dessous montre les bénéfices à court terme et à long terme de sujets traités par NurOwn par rapport au placebo.
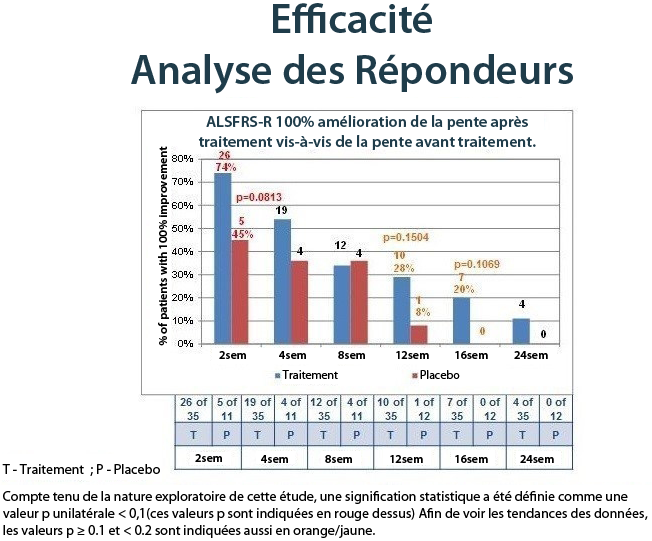
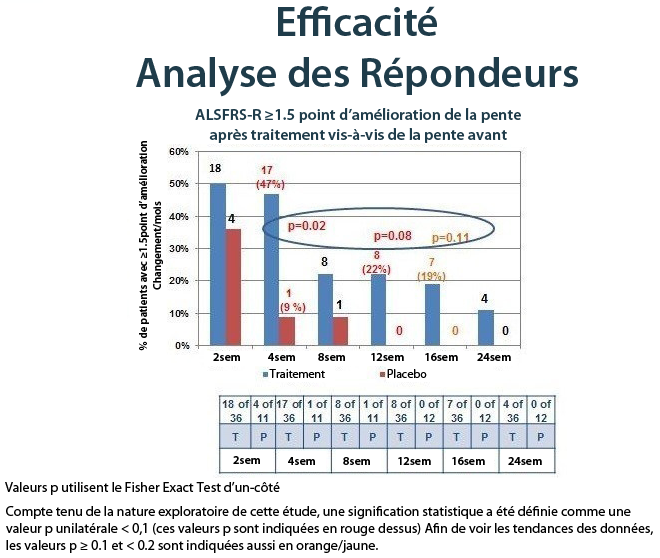
Lorsque la réponse au traitement a été évaluée comme point absolu d’amélioration par mois de la pente de l’ ALSFRS-R après le traitement par rapport à la pente avant le traitement, au fil du temps, encore une fois, il y avait des preuves solides d’un effet de traitement NurOwn. Le tableau ci-dessous montre les résultats pour les patients qui ont atteint une amélioration de point 1.5 ou plus par mois, de la pente de la ALSFRS-R à 24 semaines, démontrant un bénéfice en faveur de NurOwn à chaque moment et qui était statistiquement significative à 4, 12 et 16 semaines.
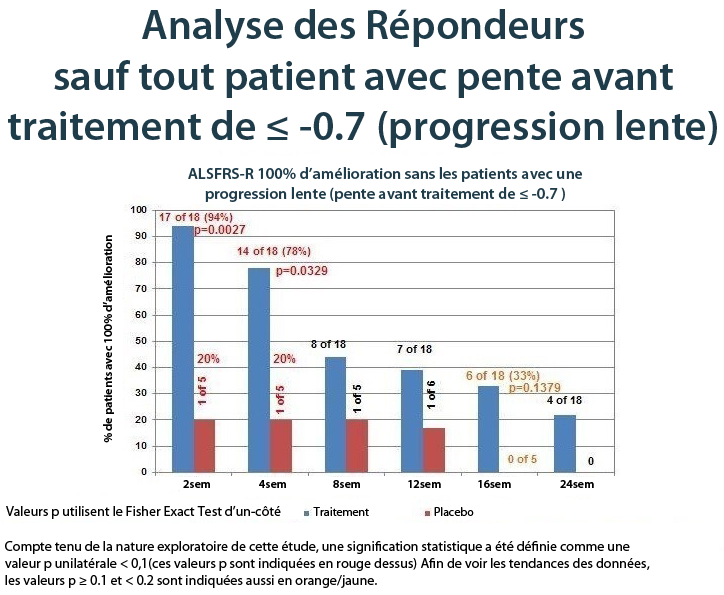
Analyses des répondeurs d’ALSFRS-R, sous-groupe avec progression plus rapide
Donné que le NurOwn est considéré de ralentir la progression de la maladie, un sous-groupe pré-spécifié a été défini afin d’exclure les sujets dont la maladie progresse lentement (définie par une pente ALSFRS-R de -0,7 ou plus pendant la phase de prétraitement). Ces sujets seraient moins susceptibles d’avoir un avantage détectable de NurOwn. Le sous-groupe progressant plus rapidement, comprenant environ la moitié des sujets de l’étude, a montré un avantage marqué du traitement NurOwn: 94 % de ceux traités avec NurOwn (n = 18) atteint les 100 % d’amélioration de la pente à 2 semaines, contre seulement 20 % dans le groupe placebo (n = 5) (p = 0,0027)(1). À 4, 8, 12, 16 et 24 semaines, la proportion de répondeurs dans le groupe de traitement actif par rapport au placebo était 78 % contre 20 %, 44 % vs 20 %, 39 % contre 17 %, 33 % contre 0 % et 22 % par rapport à 0 %. La figure ci-dessous illustre ces résultats.
Analyse de biomarqueurs
Les échantillons du liquide céphalo-rachidien (LCR, CSF) ont été prélevés chez des patients, conformément à un amendement au protocole, après que les 8 premiers patients avaient déjà été traités. Un total de 35 échantillons des visites avant et après la transplantation étaient disponibles pour l’analyse. On a mesuré les niveaux de facteurs neuro trophiques et de facteurs inflammatoires dans chaque échantillon. Une augmentation statistiquement significative de concentrations du VEGF et HGF entre avant et après la transplantation a été observée dans les échantillons des patients qui ont répondu à NurOwn. Il y avait aussi une réduction statistiquement significative des marqueurs inflammatoires (MCP-1 et SDF-1) au cours de cette période, chez les patients traités avec NurOwn ce qui n’était pas observée dans le groupe placebo.
Sécurité
NurOwn s’est avéré sûr et bien toléré avec la plupart des effets indésirables étant légers ou modérés.
Il n’y a aucun décès rapporté dans l’étude et aucun patient n’a abandonné sa participation en raison d’effets indésirables. Tous les patients des deux groupes de traitement et placebo ont connu au moins un événement indésirable lié au traitement. Les effets indésirables ont tendance d’être léger à modéré en intensité dans les deux groupes. Les événements indésirables liés au traitement, tel que déterminé par l’investigateur en aveugle, ont été légèrement plus fréquents chez les patients traités en actif que chez les patients traités par placebo, 97,2 % contre 75,0 %. Les plus grandes différences dans les fréquences ont été les réactions de douleurs localisées au site d’injection et maux de dos et des réactions systémiques, fièvre, maux de tête et arthralgie. Le profil d’événements indésirables correspond à une réaction transitoire à la transplantation. Ces effets indésirables étaient mineurs et spontanément résolutives. Les événements indésirables graves (EIG, SAE) post-thérapeutiques avaient tendance à se produire plus fréquemment chez les patients sous traitement actif (8/36, 22,2 %) que chez les patients recevant le placebo (1/12, 8,3 %). La plupart de ces SAEs étaient liés à la progression de la SLA sous-jacente, le plus fréquent était la dysphagie. Aucun EIG était lié au traitement. Le rapport bénéfice / risque reste positif pour les cellules de MSC-NTF.
(1) toutes les analyses d’efficacité ont utilisé un test alpha 1-côté = 0,10
(2) Signification clinique du changement du déclin de la ALSFRS-R, sclérose latérale amyotrophique. 2010 ; 11 : 178_180. La validité de l’utilisation d’une analyse « répondeur » et le niveau de quels points de terminaison des scores seront considérés cliniquement significatives chez les patients SLA a été exploré dans une enquête auprès de 65 cliniciens et publié en sclérose latérale amyotrophique en 2010. « Tous les participants à cette enquête ont approuvé un changement du score ALSFRS-R étant au moins quelque peu cliniquement significative à 25 % ou plus. Quatre-vingt trois pour cent des participants ont considéré un changement de 50 % du déclin comme étant très significatif cliniquement ».
Traduction : Ligue SLA : Anne
Source : BrainStorm


