Les scientifiques montrent comment l'infection est liée à des maladies neurodégénératives par le toxoplasme
24-06-2016
Le Toxoplasma gondii, un parasite protozoaire qui est environ de cinq microns, infecte un tiers de la population mondiale. Il est absorbé par la viande et des légumes non lavés et insuffisamment cuits et infecte entre 15 et 30 pour cent de la population des Etats-Unis. En France et au Brésil jusqu’à 80 pour cent de la population est infectée.
Cette infection chronique se compose de deux éléments : le parasite unicellulaire et l’inflammation du tissu qui cause cela. Elle est particulièrement dangereuse pendant la grossesse. Elle peut en effet conduire à des malformations congénitales graves et même à la mort du fœtus.
Sur la base des expériences avec des souris (qui, comme tous les mammifères sont des hôtes naturels pour ce parasite) une équipe de scientifique biomédical de Riverside de l’Université de Californie ont rapporté dans une revue PLOS Pathogens que l’infection toxoplasme conduit à un dysfonctionnement des neurotransmetteurs dans le cerveau. Dans le même article, l'équipe postule également que l'infection initie une épidémie de maladies neurologiques dans les cas qui sont naturellement sujettes à de telles maladies.
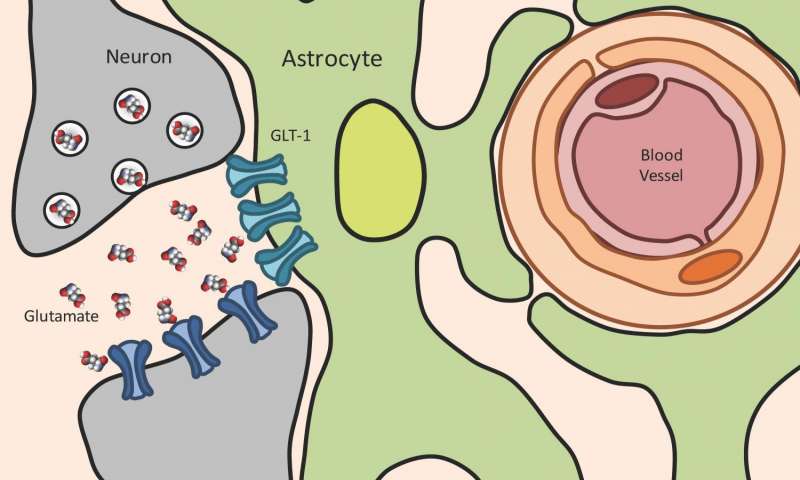
Les membres de l'équipe ont noté qu'une infection par le toxoplasme conduit à une augmentation significative du glutamate, le neurotransmetteur principal et le plus important dans le cerveau qui font passer des stimuli entre les neurones. Cette augmentation du glutamate est «extracellulaire», soit en dehors de la cellule et est strictement contrôlée par des cellules spécialisées dans le système nerveux central (cerveau et moelle épinière) qui sont appelées astrocytes. Une augmentation du glutamate est fixée d'une lésion cérébrale traumatique et des maladies neurodégénératives et très pathologiques tels que l'épilepsie, la sclérose en plaques et la sclérose latérale amyotrophique (SLA).
L'un des rôles que les astrocytes joue, est l'élimination du glutamate extracellulaire pour éviter cette augmentation pathologique à un niveau auquel les neurones s’endommagent. Ceci est réalisé essentiellement à l'aide d'un transporteur de glutamate qui est désigné GLT-1, et qui a pour fonction de réguler le glutamate extracellulaire. Le GLT-1 aspire sur le glutamate libéré par les neurones et le remets à nouveau dans une substance plus sûr la glutamine où les cellules puis l’énergie peut être puisée.
"Quand un neurone brûle, le glutamate sépare l'espace entre lui-même et le neurone à proximité", explique le chercheur principal Emma H. Wilson, professeur associé du Département des sciences biomédicales à l'École de médecine et plus de 15 ans de travail effectué dans le plan de la toxoplasmose. "Le neurone voisin détecte le glutamate, ce qui provoque l'allumage du neurone. Lorsque le glutamate est pas éliminé par le GLT-1, les neurones ne se déclenchent pas correctement la prochaine fois, et ils commencent à mourir."
Wilson et son équipe ont découvert que les astrocytes deviennent enflés au cours d'une infection par le toxoplasme et ne sont pas en mesure de réguler les concentrations de glutamate extracellulaire. En outre, GLT-1 ne s’est pas exprimé correctement. Cela conduit à une accumulation du glutamate libérée par les neurones, de sorte que les neurones ne brûlent pas bien.
"Ces résultats suggèrent qu'une infection chronique de Toxoplasma est non seulement latente et bénigne. Nous devons être conscients du risque potentiel pour les voies et les changements dans la chimie neurologique normale du cerveau", a déclaré Wilson.
Les chercheurs ont découvert que l’activateur GLT-1 a fonctionné quand ils ont infecté des souris traitées avec la ceftriaxone, un antibiotique qui a donné de bons résultats dans les modèles de souris de la SLA et le neuroprotecteur a fonctionné pour une gamme de dommages au système nerveux central. Cette restauration de GLT-1 expression a entraîné une réduction significative de glutamate extracellulaire de la pathologie à des concentrations normales et la fonction neuronale est revenue à la normale.
"Nous avons démontré pour la première fois une dislocation directe d'un neurotransmetteur majeur dans le cerveau comme une conséquence de cette infection", dit Wilson. "Mais nous avons besoin d'études plus directes et mécanistiques pour comprendre le fonctionnement réel de ce pathogène commun".
Dans une prochaine étape, Wilson et ses collègues étudieront vont rechercher ce qui fait que le facteur produit une régulation négative de GLT-1 durant une infection chronique de Toxoplasma.
"En dépit de l'importance de ce transporteur dans le maintien de la glutamate homéostasie, nous avons peu d'informations sur le mécanisme derrière son expression", dit Wilson. "Nous aimerions savoir comment les cellules, y compris les cellules immunitaires périphériques, contrôlent le parasite dans le cerveau. L'infection Toxoplasma résulte de la présence de kystes parasitaires des neurones dans le cerveau. Nous voulons continuer à travailler sur le développement d'un projet qui met l'accent sur l'éradication de ces kystes, les endroits où les parasites restent durant le reste de la vie d'une personne infectée pour échapper à la réponse immunitaire. En supprimant le kyste, on évite le risque de réactivation du parasite et le risque d'inflammation du cerveau. Cela nous indique également que nous pouvons réduire un minimum l'inflammation chronique dans le cerveau".
Curieusement, le parasite qui cause la toxoplasmose est seulement reproduite par voie sexuelle chez les chats. L’asexuée peut se répliquer et de vivre dans chaque cellule de mammifère avec un noyau. En effet, le parasite se trouve dans toutes les espèces de mammifères jamais testés.
Après l'infection, on a besoin d'un système immunitaire compétent pour empêcher la réactivation du parasite et de l'inflammation du cerveau. Les personnes dont le système immunitaire est infecté ont longtemps pris des médicaments prophylactiques tout au long de leur vie. Sinon, ils courent le risque de réactivation du kyste et peuvent même en mourir. Le parasite se trouve dans les régions du cerveau qui ont le potentiel de provoquer un comportement inhabituel, comme la recherche du risque (les souris infectées à la recherche d'urine de chat au lieu de fuir).
Le parasite est pas si latent ou dormant que les scientifiques pensaient autrefois. Les cas d'infection de toxoplasmose congénitale et de la rétine font toujours plus pour (le cerveau et la rétine sont étroitement liés les uns aux autres). Les personnes atteintes de schizophrénie sont plus à risque d'une infection de Toxoplasma, qui par ailleurs montre une certaine corrélation avec la maladie d'Alzheimer, la maladie et l'épilepsie de Parkinson.
Néanmoins, Wilson note qu'une infection est pas une raison pour de graves préoccupations.
"Nous vivons longtemps avec ce parasite," dit-elle. "Il veut que son hôte meurt sinon il perd sa maison. La meilleure façon de prévenir l'infection, est de bien cuir la chair de votre viande et de se laver les mains et les légumes. Et si vous êtes enceinte, gardez la litière dehors".
Traduction : Joséphine
Source : MedicalXpress


