Existe-t-il un changement génétique qui provoque la SLA ?
23-10-2015
Ben Locwin
Durant l’été 2014, l’Ice Bucket Challenge, engendré afin d’accroitre la conscience publique en matière de sclérose latérale amyotrophique, a été mis en route. Cela est devenu une vraie sensation dans les médias sociaux. 440 millions de personnes ont été témoins 10 milliards de fois des vidéos des participants à l’Ice Bucket Challenge. Cela a autorisé d’augmenter la sensibilisation à la maladie, des dépenses triplées du ALS Association en vue de la recherche et a abouti à un nombre accru de donations. Cet évènement connaitra une suite tous les mois d’août (#ALSIceBucketChallenge).
La SLA est une maladie neurologique qui touche les neurones qui régissent les muscles corporels. Dans la plupart des cas, elle avance à pas rapides, se terminant par la mort entre 2 à 5 ans en moyenne, aux dires de la ALS Association. Aux yeux des chercheurs, dans 90 % des cas, les causes de la SLA sont inconnues, tandis que pour les 10 % restants, il s’agirait d’un patrimoine génétique.
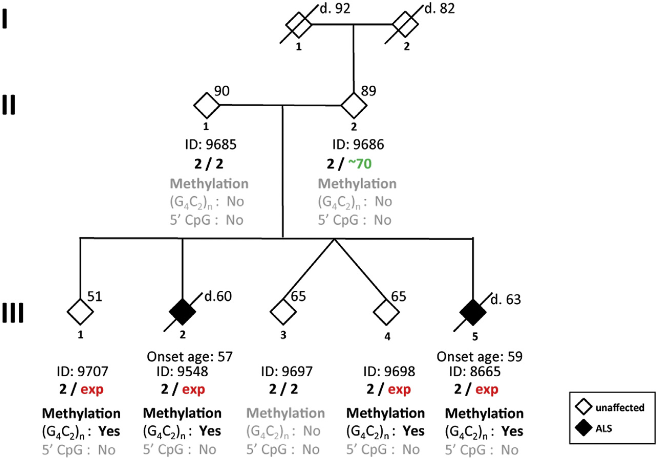
La nouvelle ligne de recherche, publiée dans le American Journal of Human Genetics, débat des mutations du gène C9orf72. Celui-ci peut être associé à une séquence ADN instable qui, répétée suffisamment de fois, peut être identifiée au développement de la SLA. La recherche nouvellement publiée se concentre sur trois générations d’une même famille ainsi que sur le gène C9orf72 et ses répétitions. Il s’avère que ni les grands-parents, ni les parents de la troisième génération cités dans l’étude n’ont développé la SLA contrairement à 4 des 5 enfants de la troisième génération.
Selon l’étude, le père avait 70 répétitions non méthyles et les enfants affectés une mutation augmentant au-delà de 1000 répétitions méthyles. Ainsi, une partie de la théorie développée par les chercheurs considère que, quelque part entre la sous- et la surexpression du gène C9orf72 et les 70 à 1000 répétitions, le père ne développait pas de SLA et les enfants adultes si. L’hypothèse révèle qu’il existe un seuil au-delà duquel le changement génétique a évolué de telle sorte que la maladie se concrétise.
Un autre facteur consiste dans le fait que le C9orf72 se situe dans la membrane nucléaire auprès de neurones normaux et sains, mais pas dans des neurones malades – mais il y a un déplacement vers la membrane du plasma de la cellule neuronale. Ce qui parait important est qu’une protéine qui migre à travers la membrane neuronale de la cellule (celle autour du noyau cellulaire) est affaiblie quand le C9orf72 est disloqué.
Le déplacement de la protéine connue sous le nom de TDP-43 est incorrectement effectué auprès de ceux souffrant de SLA, et trouver une accumulation de TDP-43 dans le fluide intracellulaire est typique en cas de SLA parmi d’autres protéinopathies neuronales. Le TDP-43 (une réaction transactive qui lie la protéine ADN, 43 kiloDaltons – une mesure de sa grandeur) est connu comme étant connecté à la SLA et aux protéinopathies de démence fronto-temporale depuis un certain temps, mais le facteur causal suspecté du gène C9orf72 et la répétition du développement de gènes associés sont d’importants nouveaux facteurs dans l’étude de la SLA. Les auteurs de l’étude décèlent :
« Les mécanismes de la maladie supposés et liés au C9orf72 sont complexes... Les individus avec des développements montrent 50% moins de transcriptions C9orf72, un résultat probable d’altérations épigénétiques. En outre, un niveau plus élevé de méthylation était associé avec la SLA familiale et une durée de maladie plus brève. »
Source: Université de Toronto
Ce qui est intéressant : les chercheurs ont suggéré que les changements de méthylation épigénétique « de la répétition de l’accroissement est un mécanisme de protection afin de diminuer la production de ARN toxique et de dipeptides, qui mènent vers les dommages collatéraux », et de manière semblable, les méthylations ont été associées à l’expression décroissante du gène C9orf72.
La SLA n’est pas spécifiquement associée à la détérioration cognitive; l’exemple le plus familier, celui de Stephen Hawking souffrant de SLA, est souvent utilisé afin de démontrer que bien qu’il soit physiquement appauvri, son esprit continue de fonctionner à un niveau invraisembablement élevé. Il y a cependant des rapports de détérioration de la mémoire et de dépression chez certains patients atteints de SLA.
Il s’avère plutôt difficile de contrôler la cause de la dépression ou des problèmes de mémoire vu le stress physique et psychologique considérables (étant présents dans le développement de la SLA) ils peuvent tous deux amener la dépression ou la détérioration de la mémoire. Ou il pourrait exister un lien causal suite auquel le stress de la maladie conduit à la dépression, qui est lui-même un précurseur ou comorbidité associées aux problèmes de mémoire (ou inversement, quand la maladie prive le patient de ses ressources cognitives suivant stress et anxiété, et la maladie et la détérioration de la mémoire amènent la dépression).
La manière suivante d’approcher de l’investigation de cette recherche serait de soutenir les découvertes en considérant plusieurs générations de familles supplémentaires pour constater si ces hypothèses tiennent la route. Ainsi, les chercheurs obtiendront de plus amples données sous forme du nombre de répétitions ADN oui ou non associées à la présence ou au manque de SLA. Cela pourra enrichir de plus de données sous forme du nombre de répétitions DNA liées ou non à la présence ou au manque d’ALS - c’est-à-dire quelques cas tout au plus.
L’énigme est loin d’être résolue, mais la compréhension des mécanismes génétiques et biologiques concernés nous offrent une possibilité afin de mieux prévenir ou traiter la maladie, aussi bien que d’améliorer les diagnostics afin de procurer au public de meilleures opportunités de savoir comment affronter cette maladie.
Traduction : Eric Kisbulck
Source : Genetic Literacy Project


