Antisense-oligonucleotides tegen neurodegeneratie
04-04-2020
Blair R. Leavitt and Sarah J. Tabrizi
Antisense-oligonucleotides (ASO’s) hebben het potentieel om RNA en eiwitexpressie te reduceren, te herstellen of te wijzigen. Ze kunnen dan ook mikken op de ziektepathogenese door de expressie van muterende eiwitten te wijzigen. De recente regulerende goedkeuring van ASO’s voor de pediatrische motorneuronenziekte spinale musculaire atrofie heeft een regulerend traject opgeleverd voor bijkomende ASO-therapieën voor andere ziektes van het centrale zenuwstelsel (CZS). Ontwikkelingen op het gebied van ASO-chemie en vorderingen op het gebied van afleveringsmethodes voor het CZS hebben ervoor gezorgd dat ASO’s worden gebruikt in klinische studies voor de behandeling van de ziekte van Huntington (ZH). Er bestaan momenteel geen behandelingen die de voortgang van ZH vertragen of voorkomen, maar twee lopende, op ASO’s gebaseerde klinische programma’s leverden veelbelovende resultaten op. Bovendien staan er klinische studies met ASO’s voor de behandeling van amyotrofische laterale sclerose (ALS), de ziekte van Parkinson en de ziekte van Alzheimer op stapel, en bevinden er zich nog andere in de ontwikkelingsfase voor andere neurodegeneratieve ziektes. We hopen dat op ASO’s gebaseerde benaderingen snel zullen leiden tot effectieve ziektewijzigende therapieën voor Zneurodegeneratieve ziektes.
ASO’ zijn synthetische DNA-analogen met een enkelvoudige streng. Ze zijn meestal 16 tot 22 bases lang, en die bases verbinden zich met specifieke complementaire RNA-doelwitten. Een beperking van de oorspronkelijke ASO’s die werden ontwikkeld voor klinisch gebruik was hun vatbaarheid voor snelle degradatie door cellulaire nucleasen, maar sindsdien werden chemische aanpassingen doorgevoerd om hun therapeutisch nut te verbeteren. De vervanging van zwavel door zuurstof en de wijziging van de 2′-position van suiker om 2′-O-methoxyethyl (MOE) -gemodificeerde ASO’s met een fosforothioate ruggengraat te genereren, resulteerde bijvoorbeeld in verbeterde nucleaseresistentie en potentie, en een grotere verdraagbaarheid bij patiënten. Verdere wijzigingen van het ribose suikerdeel hebben geleid tot een verbeterde effectiviteit door een verbeterde binding met doelwit-RNA’s.
ASO’s kunnen doelwitgenexpressie moduleren via tal van trajecten (2). Eén van die trajecten is via ribonuclease H1-rekrutering (RNase H1) (zie afbeelding). Na selectieve binding van het ASO met het doelwit-RNA ervan, wordt een RNA-DNA-hybride gevormd, die boodschapper-RNA (mRNA) -degradatie induceert door middel van RNase H1. Andere trajecten hangen af van de specifieke locatie van ASO-binding met doelwit-RNA. ASO’s kunnen bijvoorbeeld mikken op intron-exon-juncties in precursor-mRNA (pre-mRNA) om RNA-connectie te moduleren. ASO-gemedieerde doelwitonderdrukking kan worden verwezenlijkt door de connectie te moduleren om een out-of-frame deletie te introduceren, wat resulteert in gereduceerde eiwitexpressie door nonsense-gemedieerd verval van het corresponderende transcript. De startsites van de doelwittranslatie van ASO’s in RNA kunnen de binding van ribosomen blokkeren, wat leidt tot complete translationele inhibitie van doelwiteiwitsynthese.
ASO’s hebben verschillende voordelen ten opzichte van verwante RNA-interferentiebenaderingen. In tegenstelling tot interfererende RNA’s worden ASO’s probleemloos opgenomen door neuronen en ze hebben duidelijke dosisafhankelijke en omkeerbare effecten. ASO’s hebben ook het voordeel dat ze endogene microRNA-trajecten niet zullen satureren, een potentiële oorzaak van toxiciteit in korte remmende RNA (siRNA) -gebaseerde benaderingen. ASO’s zijn over het algemeen zeer selectief en kunnen mikken op zowel intronen als exonen omdat ze zich eerder verbinden met pre-mRNA dan met volgroeide mRNA’s, wat de selectie van specifieke doelwitsequenties mogelijk maakt voor ASO’s die zich nergens anders voordoen in het genoom. In tegenstelling tot viraal-gemedieerde siRNA-benaderingen, is de herhaalde toediening van ASO’s echter vereist om de therapeutische effecten te handhaven. Dit kan trouwens ook een voordeel zijn: als er zich een ongewenst resultaat voordoet via de onderdrukking van doelwit-RNA (of misschien niet-doelgericht RNA), beschikken ASO’s over een uit-knop omdat hun effecten volledig omkeerbaar zijn.
ZH is een overgeërfde autosomale dominante neurodegeneratieve aandoening die wordt gekenmerkt door een drievoud van motorische, cognitieve en psychiatrische kenmerken. ZH duikt op middelbare leeftijd op, met een genadeloze voortgang in de loop van 10 tot 15 jaar. ZH wordt veroorzaakt door een abnormaal geëxpandeerde CAG-herhaling in één allel van het huntingtine (HTT) -gen, dat wordt uitgedrukt als een lang polyglutaminekanaal in het muterende eiwit (mHTT) dat een toxische functietoename veroorzaakt. Tot de voorgestelde pathologische mechanismen die worden veroorzaakt door deze wijziging behoren een vroege transcriptionele disregulatie, synaptische dysfunctie, gewijzigd axonaal vesiculair verkeer, gehinderde proteostase, mHTT-aggregatie, een defectief nucleair poriëncomplex en nucleair-cytoplasmisch transport, oxidatieve schade, mitochondriale dysfunctie, en extrasynaptische excitotoxiciteit. ASO’s bieden een directe benadering om mHTT-expressie te reduceren door op het RNA ervan te mikken om het te vernietigen, waardoor de translatie van mHTT en het proximaal tot doelwit kiezen van de primaire oorzaak van de ziekte worden voorkomen. Twee op ASO gebaseerde therapeutische programma’s haalden recent de fase van klinisch onderzoek voor de behandeling van ZH.
Het op HTT gerichte ASO RG6042 ageert via RNase H1 om te mikken op zowel wild-type als muterend HTT pre-mRNA en resulteert in een verlaging van HTT. Preklinische studies van gelijkaardige op HTT gerichte ASO’s in transgene ZH-muizenmodellen demonstreerden afgenomen mHTT-concentraties in het hersenweefsel, een correctie van de transcriptionele disregulatie van het striatale gen, en fenotypische verbetering. De verlaging van mHTT bleek langdurig te zijn na zelfs maar één enkele injectie in het cerebro-spinaal vocht (CSV) van ASO bij deze muizen, wat suggereert dat de effecten van deze ASO’s langdurig zullen zijn bij ZH-patiënten. Lumbale intrathecale infusie van een gelijkaardig ASO bij niet-menselijke primaten bleek eveneens HTT effectief te verlagen in hersengebieden die relevant zijn voor de ZH-pathologie.
Bij de initiële fase 1/2a-studie van intrathecale RG6042 resulteerde de behandeling van 46 patiënten in een significante dosisafhankelijke reductie van CSV-concentraties van mHTT met 40 tot 60% (5). De CSV-concentraties van mHTT bleven dalen tijdens deze korte studie, wat suggereert dat de maximale reductie nog niet was bereikt. De hoeveelheid CSV-mHTT-reductie die werd vastgesteld bij deze studie is consistent met de reductieniveaus van mHTT die vereist zijn voor een significante fenotypische verbetering bij transgene muizenmodellen van ZH. Intrathecale aflevering van RG6042-ASO bleek veilig en goed verdraagbaar te zijn bij ZH-patiënten, en de potentiële effecten ervan op ziektewijziging en klinische resultaten worden nu beoordeeld in het kader van GENERATION HD1, een grote fase 3-studie waarbij meer van 800 ZH-patiënten zijn betrokken die zich in een vroeg stadium bevinden (NCT03761849).
De selectieve verlaging van mHTT is in theorie een aantrekkelijke benadering voor ZH-therapie omdat ze de bezorgdheid zou wegnemen over het potentieel verlies van wild-type-HTT-functie. Selectieve mHTT verlagende ASO’s die mikken op specifieke enkelvoudige nucleotide polymorfismen (ENP’s) gekoppeld aan de CAG-expansie bleken beloftevol te zijn in preklinische modellen van ZH. Er werd een scheikundig platform ontwikkeld dat het mogelijk maakt de chiraliteit van fosforothioate wijziging te controleren tijdens de ASO-synthese. Uit rapporten blijkt dat ‘stereopure’ ASO’s worden gekenmerkt door een verbeterde activiteit, stabiliteit en specificiteit vergeleken met stereo-isomere mengsels. Twee klinische studies werden in 2017 opgestart om twee verschillende stereopure ASO’s te beoordelen die mikken op specifieke met ZH geassocieerde ENP’s. Deze studies vereisen precieze genotypering om er zeker van te kunnen zijn dat het als doelwit gekozen ENP accuraat wordt gefaseerd met het HTT-allel met de CAG-expansie. Niet alle individuen met ZH kunnen worden behandeld met deze op ENP’s gebaseerde benadering, en men schat dat de twee ASO’s die worden getest toepasbaar zijn op ∼65% van de ZH-patiënten uit Noord-Amerika en Europa. Elk ASO krijgt een maandelijkse intrathecale bolus gedurende drie opeenvolgende maanden, en recent nog werd gerapporteerd dat één van de ASO’s bij de hoogste geteste dosis een bescheiden reductie van 12,4% van de CSV-concentratie van mHTT veroorzaakte. Een bijkomend cohort dat een hogere dosis krijgt zal nu aan deze studie worden toegevoegd (NCT03225833).
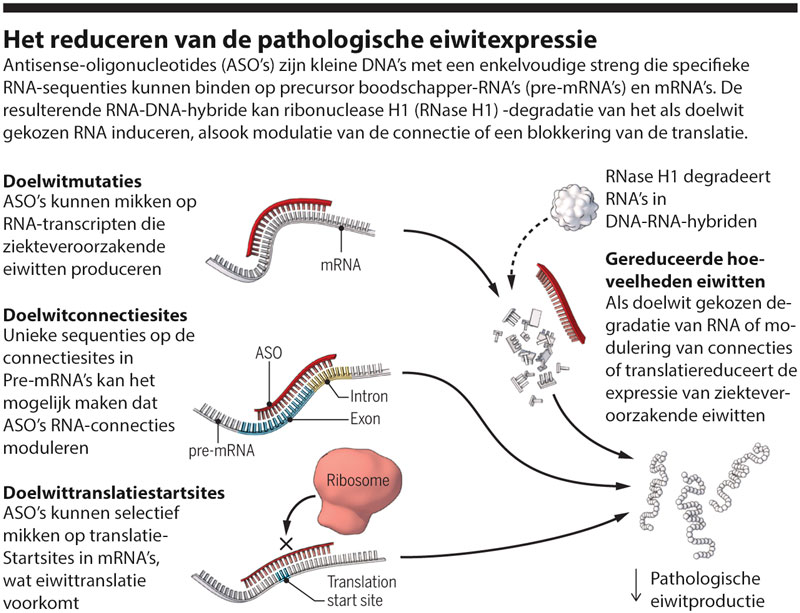
Het reduceren van de pathologische eiwitexpressie
Antisense-oligonucleotides (ASO’s) zijn kleine DNA’s met een enkelvoudige streng die specifieke RNA-sequenties kunnen binden op precursor boodschapper-RNA’s (pre-mRNAs) en mRNA’s. De resulterende RNA-DNA-hybride kan ribonuclease H1 (RNase H1) -degradatie van het als doelwit gekozen RNA induceren, alsook modulatie van de connecties, of blokkering van translatie.
Het is niet geweten of HTT-verlaging dan wel mHTT-selectieve verlaging het meest effectief zal zijn. Beide benaderingen hebben specifieke voordelen en beperkingen, en deze vraag zal uiteindelijk empirisch worden beantwoord door klinische efficiëntietests. Preklinische studies in een vermenselijkt transgeen ZH-muizenmodel kwamen tot de bevinding dat de voordelen van een ASO-gemedieerde verlaging van de totale HTT-concentraties met 75% vergelijkbaar waren met die van ASO’s die mHTT selectief reduceerden. Deze en andere studies hebben gesuggereerd dat de mate van mHTT-verlaging de meest cruciale parameter is voor preklinische efficiëntie. Een substantieel voordeel van HTT verlagende benaderingen vergeleken met op ENP gebaseerde selectieve mHTT-targeting is het potentieel om één enkel therapeutisch middel te ontwikkelen voor de volledige ZH-populatie.
Men is er optimistisch over dat ASO’s die HTT als doelwit kiezen kunnen leiden tot levensvatbare ziektewijzigende therapieën voor ZH, alsook tot de ontwikkeling van ASO’s voor andere neurodegeneratieve ziektes die worden geassocieerd met aberrante eiwitproductie. Volgend op een substantieel preklinisch ontwikkelingsprogramma bleek een superoxide dismutase 1 (SOD1) dat mikte op ASO’s veilig en goed verdraagbaar te zijn na een lumbale intrathecale infusie in een fase 1-studie voor de behandeling van SOD1-gemuteerde ALS. Een krachtiger MOE-gewijzigd ASO (ISIS-SOD1Rx) wordt momenteel geëvalueerd in een fase 1/2a klinische studie (NCT02623699). Er werden ook beloftevolle preklinische gegevens gegenereerd met behulp van op ASO gebaseerde benaderingen voor de ziekte van Parkinson, met als doelwit herhalingskinase 2 die rijk is aan leucine (LRRK2, NCT03976349) en α-synucleïne; voor de ziekte van Alzheimer door te mikken op het Tau-eiwit, dat momenteel onderzocht wordt in een fase 1 klinische studie (NCT03186989); en voor prionziektes door te mikken op het prioneiwit PRP.
Op ASO gebaseerde therapieën zijn ook interessant bij ziektes waarvan de etiologie vergelijkbaar is met die van ZH, zoals de polyglutamine-eiwitgerelateerde vormen van spinocerebellaire ataxie die worden veroorzaakt door polyglutamine-inclusies, en bij frontotemporale degeneratie (FTD) met pathologische inclusies van Tau of het TAR DNA-bindend eiwit 43 (TDP- 43). Het is trouwens zo dat ASO’s die de ataxine 2-expressie verlagen gunstig bleken te werken bij muizenmodellen van zowel spinocerebellaire ataxie 2 en TDP-43-gerelateerde FTD. De meest gangbare genetische oorzaak van ALS en FTD is een GGGGCC-herhalingsexpansie in het C9ORF72-gen, dat RNA-gemedieerde neurotoxiciteit induceert. ASO’s die selectief mikken op de herhalingen bevattende RNA’s kunnen een nuttige therapeutische benadering vormen voor deze klasse van ziektes; men werkt aan de ontwikkeling van klinische studies.
ASO’s hebben het landschap voor de therapeutische ontwikkeling voor neurodegeneratieve ziektes al veranderd. Om ze naar de kliniek te brengen zal nog meer ontwikkeling en onderzoek vereist zijn, waaronder de optimalisering van doelwitsequentieselectie, een verbetering van de biologische activiteit, het testen van nieuwe afleveringstechnologieën, en het onderhouden van een gepast veiligheidsprofiel. Het verbeteren van de aflevering van ASO’s om te mikken op cellen is een belangrijk gebied voor toekomstige ontwikkelingen, waaronder intrathecale pompen en het gebruik van op vetten gebaseerde en op polymeren gebaseerde nanodragers. Dergelijke afleveringssystemen zullen de gecontroleerde vrijgave van ASO’s en de cel- en weefselspecificiteit potentieel verbeteren, en zullen mogelijk bescherming bieden tegen nucleasedegradatie. Naast potentie en specificiteit is er nog een ander cruciaal kenmerk van een goede kandidaat-molecule: het vermogen om het intracellulair doelwit te bereiken in toereikende concentraties. Gezien de substantieel toegenomen potentie van MOE-gewijzigde ASO’s moeten we ons zorgen maken over de veiligheid van een excessieve on-target verlaging van eiwitten (zoals wild-type HTT) en potentiële off-target effecten. Het is van kapitaal belang dat zowel de potentie als de off-target effecten extensief preklinisch worden beoordeeld bij de ontwikkeling van nieuwe ASO-therapieën.
De ASO RG6042 is het resultaat van meer dan 10 jaar extensieve preklinische beoordelingen in meervoudige modelsystemen en getuigt van effectieve samenwerking tussen de academische wereld en de industrie bij de ontwikkeling van geneesmiddelen. Met een steeds toenemend aantal ASO-therapieën dat getest wordt in klinische studies, heeft deze opwindende technologie het potentieel om in de nabije toekomst het therapeutische landschap te veranderen voor veel neurologische en niet-neurologische aandoeningen (waaronder kanker, en cardiovasculaire, besmettelijke en longziektes).
Vertaling: Bart De Becker
Bron: Science


