Oligonucléotides antisens pour la neurodégénérescence
04-04-2020
Blair R. Leavitt and Sarah J. Tabrizi
Les oligonucléotides antisens (ASO) ont le potentiel de réduire, restaurer ou modifier l'expression de l'ARN et des protéines. Ainsi, ils peuvent cibler la pathogenèse de la maladie en modifiant l'expression des protéines mutantes. L'approbation réglementaire récente des ASO pour l'atrophie musculaire spinale de la maladie des motoneurones pédiatriques a fourni une voie réglementaire pour des thérapies ASO supplémentaires dans d'autres maladies du système nerveux central (SNC). Les progrès de la chimie des ASO et les progrès des méthodes d'administration du SNC ont permis aux ASO d'entrer dans des essais cliniques pour traiter la maladie de Huntington (HD). Il n'y a actuellement aucun traitement disponible qui ralentit ou empêche la progression de la HD, mais deux programmes cliniques en cours basés sur l'ASO ont montré des résultats prometteurs. De plus, des essais cliniques d'ASO pour traiter la sclérose latérale amyotrophique (SLA), la maladie de Parkinson et la maladie d'Alzheimer sont en cours, et d'autres sont en cours de développement pour d'autres maladies neurodégénératives. On espère que les approches basées sur l'ASO fourniront bientôt des thérapies efficaces de modification des maladies pour la MH et les maladies neurodégénératives similaires.
Les ASO sont des analogues synthétiques d'ADN simple brin, généralement de 16 à 22 bases de long, qui se lient sélectivement à des cibles d'ARN complémentaires spécifiques. Une limitation des ASO originaux développés pour une utilisation clinique était la sensibilité à la dégradation rapide par les nucléases cellulaires, mais des modifications chimiques ont depuis été introduites pour améliorer leur utilité thérapeutique. Par exemple, la substitution du soufre à l'oxygène et la modification de la position 2 'du sucre pour générer des ASO modifiés 2'-O-méthoxyéthyle (MOE) avec un squelette phosphorothioate ont entraîné une résistance aux nucléases, une puissance et une meilleure tolérance améliorées chez les patients. D'autres modifications du fragment sucre ribose ont conduit à une efficacité améliorée en améliorant la liaison aux ARN cibles.
Les ASO peuvent moduler l'expression du gène cible à travers de nombreuses voies (2). L'une de ces voies passe par le recrutement de ribonucléases H1 (RNase H1) (voir la figure). Après la liaison sélective de l'ASO à son ARN cible, un hybride ARN-ADN est formé, ce qui induit la dégradation de l'ARN messager (ARNm) par la RNase H1. D'autres voies dépendent de l'emplacement spécifique de la liaison de l'ASO à l'ARN cible. Par exemple, les ASO peuvent cibler les jonctions intron-exon dans l'ARNm précurseur (pré-ARNm) pour moduler l'épissage de l'ARN. La suppression de cible médiée par ASO peut être obtenue en modulant l'épissage pour introduire une délétion hors cadre, ce qui entraîne une expression des protéines réduite par une désintégration induite par le non-sens du transcrit correspondant. Les ASO ciblant les sites de départ de la traduction dans l'ARN peuvent bloquer la liaison des ribosomes, conduisant à une inhibition translationnelle complète de la synthèse des protéines cibles.
Les ASO présentent plusieurs avantages par rapport aux approches d'interférence ARN associées. Contrairement aux ARN interférents, les ASO sont facilement absorbés par les neurones et ont des effets clairement dépendants de la dose et réversibles. Les ASO ont également l'avantage de ne pas saturer les voies endogènes de microARN, une cause potentielle de toxicité dans les approches à base d'ARN inhibiteur court (siARN). Les ASO sont généralement très sélectifs et peuvent cibler à la fois les introns et les exons car ils se lient au pré-ARNm plutôt qu'aux ARNm matures, permettant la sélection de séquences cibles spécifiques pour les ASO qui n'apparaissent nulle part ailleurs dans le génome. Cependant, contrairement aux approches par ARNi à médiation virale, l'administration répétée d'ASO est nécessaire pour maintenir les effets thérapeutiques. Cela peut également être un avantage: si un résultat indésirable se produit de la suppression de l'ARN cible (ou peut-être de l'ARN hors cible), les ASO ont un interrupteur de désactivation car leurs effets sont entièrement réversibles.
La HD (maladie de Huntington) est un trouble neurodégénératif autosomique dominant hérité caractérisé par une triade de caractéristiques motrices, cognitives et psychiatriques. La HD survient généralement au milieu de la vie, avec une progression inexorable du handicap sur 10 à 15 ans. La MH est causée par une répétition anormalement étendue de CAG dans un allèle du gène de la huntingtine (HTT), qui est exprimée sous la forme d'un long tractus polyglutamine dans la protéine mutante (mHTT) qui confère un gain de fonction toxique. Les mécanismes pathologiques proposés causés par cette altération comprennent une dérégulation transcriptionnelle précoce, un dysfonctionnement synaptique, un trafic vésiculaire axonal altéré, une protéostase altérée, une agrégation mHTT, un complexe de pores nucléaires défectueux et un transport nucléaire-cytoplasmique, des dommages oxydatifs, un dysfonctionnement mitochondrial et une excitotoxicité extrasynaptique. Les ASO fournissent une approche directe pour réduire l'expression du mHTT en ciblant son ARN pour la destruction, empêchant ainsi la traduction du mHTT et ciblant de manière proximale la cause principale de la maladie. Deux programmes thérapeutiques basés sur l'ASO ont récemment fait l'objet d'essais cliniques pour le traitement de la MH.
L'ASO RG6042 ciblant HTT agit via la RNase H1 pour cibler à la fois le pré-ARNm HTT de type sauvage et mutant et entraîne une diminution de HTT. Des études précliniques d'ASO ciblant le HTT similaires dans des modèles de souris transgéniques HD ont démontré une diminution des concentrations de mHTT dans le tissu cérébral, une correction de la dérégulation transcriptionnelle du gène striatal et une amélioration phénotypique. L'abaissement du mHTT a été prolongé même après une seule injection de liquide céphalo-rachidien (LCR) d'ASO chez ces souris, ce qui suggère que les effets de ces ASO seront prolongés chez les patients HD. La perfusion intrathécale lombaire d'un ASO similaire chez des primates non humains s'est également avérée réduire efficacement la HTT dans de nombreuses régions du cerveau pertinentes pour la pathologie HD.
Lors de l'essai initial de phase 1 / 2a du RG6042 intrathécal, le traitement de 46 patients a entraîné une réduction dose-dépendante significative des concentrations de mHTT dans le LCR de 40 à 60% (5). Les concentrations de mHTT dans le LCR ont continué de diminuer au cours de cette courte étude, ce qui suggère que la réduction maximale n'a pas été atteinte. La quantité de réduction du mHTT du LCR observée dans cette étude est cohérente avec les réductions du mHTT nécessaires pour une amélioration phénotypique significative des modèles murins transgéniques de la MH. L'administration intrathécale de RG6042 ASO était sûre et bien tolérée chez les patients HD, et ses effets potentiels sur la modification de la maladie et les résultats cliniques sont en cours d'évaluation dans le cadre de GENERATION HD1, un grand essai de phase 3 impliquant plus de 800 patients HD au stade précoce (NCT03761849).
L'abaissement sélectif du mHTT est théoriquement une approche attrayante de la thérapie HD car il permettrait de surmonter les préoccupations concernant la perte potentielle de la fonction HTT de type sauvage. Les ASO sélectifs abaissant le mHTT qui ciblent des polymorphismes mononucléotidiques spécifiques (SNP) liés à l'expansion du CAG sont prometteurs dans les modèles précliniques de la MH. Une plateforme de chimie a été développée qui permet de contrôler la chiralité de la modification du phosphorothioate pendant la synthèse de l'ASO. Il est rapporté que les ASO «stéréopures» ont une activité, une stabilité et une spécificité améliorées par rapport aux mélanges de stéréoisomères. Deux essais cliniques ont été lancés en 2017 pour évaluer deux ASO stéréopures différents ciblant des SNP associés HD spécifiques. Ces études nécessitent un génotypage précis pour garantir que le SNP ciblé est phasé avec précision sur le HTTallele avec l'expansion CAG. Tous les individus atteints de HD ne peuvent pas être traités avec cette approche basée sur les SNP, et on estime que les deux ASO testés sont applicables à environ 65% des patients HD d'Amérique du Nord ou d'Europe. Chaque ASO est administré en bolus intrathécal mensuel sur trois mois consécutifs, et il a été récemment rapporté qu'à la dose la plus élevée testée, l'un des ASO a provoqué une réduction modeste de 12,4% de la concentration de mHTT dans le LCR. Une cohorte de doses plus élevées sera désormais ajoutée à cet essai (NCT03225833).
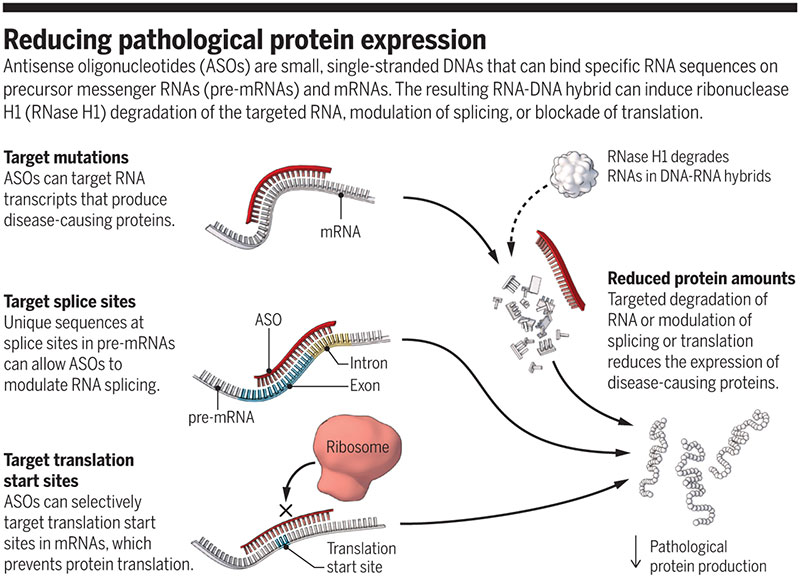
Réduire l'expression des protéines pathologiques
Les oligonucléotides antisens (ASO) sont de petits ADN simple brin qui peuvent lier des séquences d'ARN spécifiques sur des ARN messagers précurseurs (pré-ARNm) et des ARNm. L'hybride ARN-ADN résultant peut induire une dégradation de la ribonucléase H1 (RNase H1) de l'ARN ciblé, une modulation de l'épissage ou un blocage de la traduction.
On ne sait pas si l'abaissement du HTT ou l'abaissement sélectif du mHTT sera le plus efficace. Les deux approches ont des forces et des limites distinctes, et cette question trouvera finalement une réponse empirique dans les essais d'efficacité clinique. Des études précliniques dans un modèle de souris transgénique humanisé HD ont révélé que les avantages de l'abaissement médié par l'ASO des concentrations totales de HTT de 75% étaient similaires à ceux des ASO qui réduisaient sélectivement le mHTT. Ces études et d'autres ont suggéré que le degré d'abaissement du mHTT est le paramètre le plus critique pour l'efficacité préclinique. Un avantage substantiel des approches HTTlowering par rapport au ciblage mHTT sélectif basé sur SNP est le potentiel de développer un agent thérapeutique unique pour l'ensemble de la population HD.
Il existe un optimisme quant au fait que les ASO ciblant le HTT peuvent conduire à une thérapie viable de modification de la maladie pour la HD (maladie de Huntington), ainsi qu'au développement d'ASO pour d'autres maladies neurodégénératives associées à la production de protéines aberrantes. À la suite d'un important programme de développement préclinique, un ASO ciblant la superoxyde dismutase 1 (SOD1) s'est révélé sûr et bien toléré après une perfusion intrathécale lombaire dans un essai de phase 1 pour le traitement de la SLA mutée par SOD1. Un ASO modifié par le ME plus puissant (ISIS-SOD1Rx) est en cours d'évaluation dans un essai clinique de phase 1 / 2a (NCT02623699). Des données précliniques prometteuses ont également été générées en utilisant des approches basées sur l'ASO pour la maladie de Parkinson, ciblant la kinase répétée riche en leucine 2 (LRRK2, NCT03976349) et la α-synucléine; pour la maladie d'Alzheimer en ciblant la protéine Tau, qui fait actuellement l'objet d'un essai clinique de phase 1 (NCT03186989); et pour les maladies à prions en ciblant la protéine prion PRP.
Les thérapies à base d'ASO sont également intéressantes pour les maladies dont l'étiologie est similaire à celle de la HD, telles que les formes d'ataxie spinocérébelleuse liées aux protéines polyglutamines qui sont causées par des inclusions de polyglutamine, et dans la démence frontotemporale (FTD) avec l'ADN Tau ou TAR- liaison des inclusions pathologiques de la protéine 43 (TDP-43). En effet, les ASO qui réduisent l'expression de l'ataxine 2 ont montré des avantages dans les modèles murins de l'ataxie spinocérébelleuse 2 et du FTD lié au TDP-43. La cause génétique la plus courante de la SLA et de la FTD est une expansion répétée du GGGGCC dans le gène C9ORF72 qui induit une neurotoxicité induite par l'ARN. Les ASO qui ciblent sélectivement ces ARN contenant des répétitions peuvent être une approche thérapeutique utile pour cette classe de maladies; des essais cliniques sont en cours de développement.
Les ASO ont déjà changé le paysage du développement thérapeutique des maladies neurodégénératives. Leur avancement dans la clinique nécessitera un développement et des recherches continus, y compris l'optimisation de la sélection de la séquence cible, l'amélioration de l'activité biologique, le test de nouvelles technologies d'administration et le maintien d'un profil de sécurité approprié. L'amélioration de la livraison des ASO aux cellules cibles est un domaine important de développement futur, y compris les pompes intrathécales et l'utilisation de nanoporteurs à base de lipides et à base de polymères. De tels systèmes d'administration amélioreront potentiellement la libération contrôlée d'ASO et la spécificité cellulaire et tissulaire, et pourraient fournir une protection supplémentaire contre la dégradation des nucléases. Au-delà de la puissance et de la spécificité, une autre caractéristique cruciale d'une bonne molécule candidate est la capacité d'atteindre sa cible intracellulaire à une concentration suffisante. Compte tenu de la puissance considérablement accrue des ASO modifiés par le ME, il existe des problèmes de sécurité concernant l'abaissement excessif des protéines sur la cible (comme le HTT de type sauvage) et les effets potentiels hors cible. Il est essentiel qu'une évaluation préclinique approfondie de la puissance et des effets hors cible soit effectuée dans le développement de nouvelles thérapies ASO.
L'ASO RG6042 est le résultat de plus d'une décennie d'évaluation préclinique approfondie dans plusieurs systèmes modèles et témoigne d'une collaboration efficace entre les universités et l'industrie dans le développement de médicaments. Avec un nombre croissant de thérapies ASO testées dans des essais cliniques, cette technologie passionnante a le potentiel de changer le paysage thérapeutique pour de nombreuses conditions neurologiques et non neurologiques (y compris le cancer et les maladies cardiovasculaires, infectieuses et pulmonaires) dans un avenir proche.
Traduction : Christina Lambrecht
Source : Science


