Om hersenziektes een halt toe te roepen, richten geneesmiddelen zich op eiwitverkeersopstoppingen die neuronen vernietigen
21-01-2019

Het normale facetoog van een vlieg (links) is ontsierd door strengvormige celdood (rechts) door toedoen van een mutatie die amyotrofische laterale sclerose veroorzaakt.
De facetogen van de gewone fruitvlieg zijn normaal gezien baksteenrood, maar in het labo van neuroloog Tom Lloyd aan de Medische School van de Johns Hopkins University in Baltimore, Maryland, zijn de ogen van veel vliegen gepokt met witte en zwarte vlekken, een indicatie dat de neuronen in elk van hun zowat 800 oogfacetten verschrompelen en afsterven.
Deze vliegen lijden aan het genetische equivalent van de slopende neurodegeneratieve ziekte amyotrofische laterale sclerose (ALS), en hun ogen bieden een zeldzame blik op het ziekteproces. Door de omvang van de schade af te meten van de ogen van elk insect kunnen onderzoekers snel inschatten of een geneesmiddel, een genetische modificatie, of enige andere therapeutische interventie het neuronaal verlies helpt te stelpen.
Deze ogen hebben ook het centrale mysterie van ALS ontraadseld: wat is precies de doodsoorzaak van neuronen — en uiteindelijk van de patiënt?
De vliegen dragen een mutatie die wordt aangetroffen bij zowat 40% van de ALS-patiënten die een familiegeschiedenis van de ziekte hebben, en bij zowat 10% van de sporadische gevallen. De mutatie, in een gen dat C9orf72 wordt genoemd, bestaat uit honderdduizenden extra kopieën van een korte DNA-sequentie, die slechts zes basen lang is. Dit leidt tot ongewoon lange strengen RNA die zich vasthaken op honderden eiwitten in de celkern, zodat die worden uitgeschakeld. Lloyd en Jeffrey Rothstein, zijn college aan Hopkins, formuleerden de hypothese dat sommige van deze met RNA verstrengelde eiwitten de sleutel kunnen bevatten tot ALS.
In de loop van vele maanden bestudeerden de onderzoekers systematisch de rol van elk eiwit door vliegstrengen te ontwikkelen die zowel de ALS-mutatie als een onklaar gemaakte of hyperactieve versie van het gen van elk eiwit dragen. Eén groep vliegen, die werd gekweekt met verhoogde niveaus van het eiwit RanGAP, trok de bijzondere aandacht van de onderzoekers. Vijftien dagen nadat de vliegen zich hadden ontpopt, bleven hun ogen de kleur van zuivere gebrande siëna-aarde behouden. RanGAP "bleek verreweg de krachtigste onderdrukker van neurodegeneratie", zegt Lloyd. Wat geweten was over de functie ervan, was aanlokkelijk: het eiwit diende als een soort boodschapper die andere eiwitten helpt het membraan te doordringen dat de celkern scheidt van het cytoplasma.
Het resultaat van het team zou het begrip op zijn kop zetten dat neurowetenschappers hadden van ALS en hersenziektes in het algemeen, en anderen zaten op hetzelfde spoor. In 2015 rapporteerden twee andere onderzoeksteams dat stoornissen in het nucleaire transportsysteem van de cel handelsmerken waren van niet alleen ALS, maar ook van frontotemporale degeneratie (FTD), een andere progressieve hersenziekte veroorzaakt door C9orf72-mutaties. Algauw zouden wetenschappers het disfunctionele verkeer over de nucleaire scheiding koppelen aan andere neurodegeneratieve ziektes — Alzheimer, Huntington, spinocerebellaire ataxie — en zelfs het normale verouderingsproces. Bij al deze aandoeningen ontaardden de resulterende abnormale eiwitstapelingen op de één of andere manier in kwaadaardige neuronendoders.
"Ik word vaak ongemakkelijk als iemand een ontdekking doet en die dan beschouwt als algemeen toepasbaar", zegt Rothstein, een neuroloog die directeur is van het Hersenwetenschapsinstituut van Johns Hopkins. In dit geval lijkt dit echter te kloppen.
De bevindingen zijn niet louter academisch. Ze werken inspirerend op therapeutische inspanningen om de oorzaak aan te pakken van doorsnee leeftijdsgerelateerde neurodegeneratie — een oogmerk dat ontwikkelaars van geneesmiddelen grotendeels is ontgaan. Als het geleidelijke verlies van nucleocytoplasmisch transport een basiskenmerk is van de verouderende hersenen, zegt Sami Barmada, een neuroloog aan de University of Michigan in Ann Arbor, dan is het voorkomen van dit fenomeen "mogelijk een brede en effectieve therapie".
Verschillende biotechondernemingen hebben dit idee willen uitwerken door het uit te testen op dierenmodellen en plannen te maken voor de eerste onderzoeken op mensen, dit jaar nog. De belangrijkste ervan is Biogen in Cambridge, Massachusetts, dat in 2018 de rechten kocht om de geneesmiddelenverbinding KPT-350 te ontwikkelen, die het nucleaire transport als rechtstreeks doelwit kiest. Het onderzoek dat aan de basis ligt van de werking van dat geneesmiddel is gloednieuw, maar "de biologie is een feit", zegt Chris Henderson, hoofd onderzoek naar neuromusculaire en bewegingsaandoeningen bij Biogen. "Het is een goed rationeel onderbouwd geneesmiddel", voegt hij eraan toe, "en we zijn optimistisch over de kansen om dit succesvol uit te testen".
De nucleaire grens overschrijden
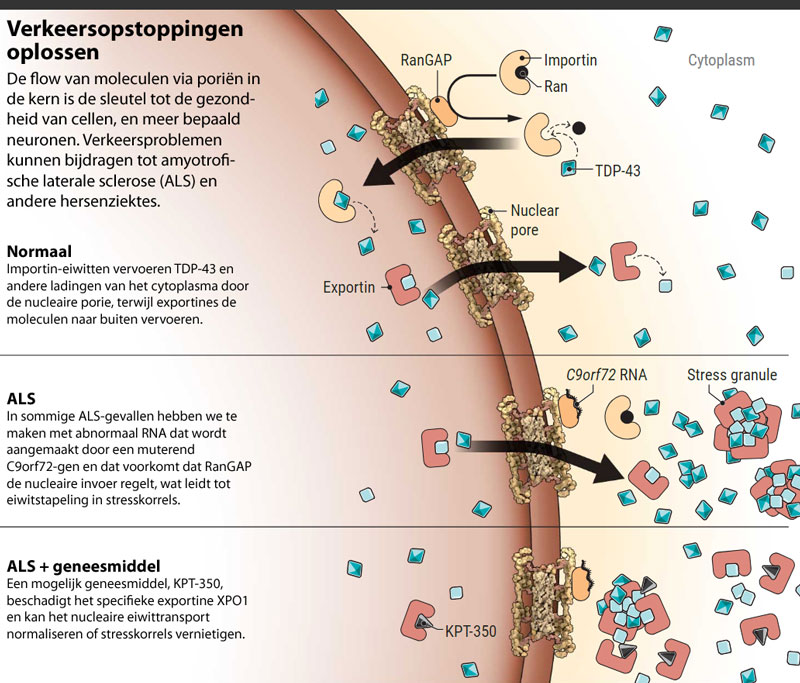
Het vetmembraan dat de met DNA gevulde kern scheidt van de rest van de cel is als een internationale grensovergang met industrieel verkeer in twee richtingen. DNA-bindende eiwitten en andere moleculen vloeien voortdurend in de kern, om bijvoorbeeld genen aan en uit te schakelen. De boodschapper-RNA's die worden geproduceerd door deze genen vloeien de andere richting uit, naar eiwitassemblageplatformen in het cytoplasma. De cel moet dat verkeer regelen via toegangspunten die gekend zijn als nucleaire poriën. Als die toegangspoorten verstopt raken, is het logisch dat de cel hier nadeel van zal ondervinden.
De eerste aanwijzingen dat ontregeld nucleair transport aan de basis zou kunnen liggen van ALS kregen we in 2010, toen onderzoekers aan King's College London die werkten met menselijke kankerzenuwcellen experimenteel de expressie blokkeerden van eiwitten die waren betrokken bij de 'importbusiness'. Het resultaat was iets wat we ook vaststellen in cellen van ALS-patiënten: klonters van het eiwit TDP-43 die zich opstapelen in het cytoplasma.
Slechts weinig ALS-onderzoekers besteedden veel aandacht aan dat vroege verslag. Het was niet duidelijk wat precies het transportmechanisme spaak deed lopen bij ALS-patiënten, en de onderzoekers konden niet zeggen of de opstapeling van TDP-43 — een eiwit dat zich normaal gezien in de kern verbindt met zowel DNA als RNA om de verschillende stadia van genexpressie te regelen — de beruchte neuronendoder was dan wel slechts een gevolg van een ander toxisch proces. Er zouden nog vijf jaar over gaan — en de studie van Lloyd en Rothstein van de vliegen met de veelzeggende ogen — voordat ALS-wetenschappers de kwestie van het nucleair transport wat ernstiger zouden nemen.
"Het is een goed rationeel onderbouwd geneesmiddel en we zijn optimistisch over de kansen om dit succesvol uit te testen."
Chris Henderson, Biogen
Het resultaat van het Hopkins-team deed bij collega's de oren spitsen, deels omdat het een transporteiwit had geïdentificeerd, RanGAP, als sleutel tot neurodegeneratie. Het team toonde zowel bij vliegenmodellen van ALS als bij cellen van menselijke patiënten aan dat de lange RNA-strengen die werden geproduceerd door het muterende C9orf72-gen zich aan RanGAP leken vast te hechten nabij de nucleaire porie en zo het eiwit uitschakelden. Het verlies van functionerend RanGAP zorgde voor vertraging in het nucleaire invoersysteem, wat leidde tot een cytoplasmische opstapeling van eiwitten zoals TDP-43 — die zich ophoopten in een cel zoals rottend afval dat zich opstapelt bij een staking van de vuilnismannen.
Al even prikkelend was de bevinding van het team dat een potentieel geneesmiddel de neuronale gezondheid wist te vrijwaren, tenminste toch bij de vliegen. "Plots beschikten we over een potentiële behandelingsbenadering", zegt Dorothee Dormann, een biochemica van de Ludwig Maximilian-universiteit in München, Duitsland.
Het team beschikte niet over een geneesmiddel dat de niveaus van RanGAP in het cytoplasma kon opdrijven en de inflow voldoende kon herstellen om de oogneuronen te redden, maar Lloyd ging ervan uit dat het blokkeren van de outflow van TDP-43 en andere nucleaire eiwitten hetzelfde heilzame effect kon sorteren. Van de experimentele verbinding KPT-276 was geweten dat ze het cruciale nucleaire eiwit exportin 1 (XPO1) selectief remt. De benadering was onorthodox, een evenwichtsoefening tussen twee kwalen — defectieve inflow en outflow — maar het werkte. Toen Lloyd KPT-276 toediende aan zijn ALS-vliegen, bleven hun ogen maagdelijk.
Van kankerbestrijder tot hersenbeschermer
KPT is de code voor een experimentele verbinding die wordt gehanteerd door Karyopharm Therapeutics, een kleine geneesmiddelenonderneming uit Newton, Massachusetts. Karyopharm werd in 2008 opgericht om XPO1-remmers te ontwikkelen voor de behandeling van kanker. Het achterliggende idee was het stimuleren van een opbouw van tumoronderdrukkende eiwitten in de kern, waar ze als een soort waakhond tegen kanker fungeren. We zijn tien jaar later en men gaat er algemeen van uit dat de eerste klinische kandidaat van de onderneming, een geneesmiddel tegen multipel myeloom, in de komende maanden marketinggoedkeuring zal krijgen.
Scheikundigen van Karyopharm ontwikkelden een gamma van XPO1-remmers, waaronder KPT-276 en het verwante product KPT-350, die een belangrijk kenmerk hadden: ze overschreden de bloed-hersenbarrière gemakkelijker dan andere kandidaten. KPT-350 bleek krachtiger en minder toxisch in preklinische tests, en de onderneming ging dan ook op zoek naar manieren om het te gebruiken voor de behandeling van hersenziektes en -schade.
De resultaten van Lloyd en Rothstein wekten de interesse van de onderneming. Toen Sharon Tamir, het toenmalige hoofd neurodegeneratieve en besmettelijke ziektes, vernam dat de Hopkins-onderzoekers werkten met KPT-276 in plaats van KPT-350, nam ze contact met hen op om hen voor te stellen samen te werken en gebruik te maken van de 'betere' verbinding. Ondertussen begon ze KPT-350 te verdelen bij andere groepen in Japan, België en de Verenigde Staten. De wetenschappers toonden gezamenlijk de neurobeschermende effecten van het geneesmiddel aan voor een brede waaier van vliegen-, knaagdieren- en menselijkecelmodellen van ALS, Huntington en andere hersenziektes.

Een ingekleurd atoomkrachtmicrogram toont de complexe poriën (groene ringen) die instaan voor het nauwgezet regelen van het celverkeer tussen de kern en het cytoplasma. - H.oberleithner, University Hospital Of Muenster/science Source
Behandeling met KPT-350 vrijwaarde bijvoorbeeld de gezondheid van axonen, de lange, signalen verzendende extensies van zenuwcellen, en verbeterde de motorische functies van muizen met een aandoening die op multiple sclerose lijkt. Dat werd aangetoond door een team geleid door neurowetenschapper Jeffery Haines aan de Icahn Medische School aan Mount Sinai in New York City. De Hopkins-groep slaagde er dan weer in met behulp van het geneesmiddel muizenneuronen in leven te houden die drager waren van de mutatie die geassocieerd wordt met Huntington.
"Er valt nog heel wat te exploreren over de reden waarom het complex van nucleaire poriën zo gevoelig is voor problemen in verschillende types neuronen in verschillende hersengebieden, met als gevolg veelvoudige en verschillende ziektes", zegt Gavin Daigle, een voormalige postdoc in het labo van Rothstein die meewerkte aan het Huntington-project en meehielp de gestoorde poriënfunctie te koppelen aan Alzheimer, alvorens hij lid werd van AbbVie in Cambridge. Hij benadrukt echter dat al het onderzoek één zaak duidelijk maakt: "Dit is een traject dat als doelwit kan worden gekozen".
De resultaten bewezen meer dan genoeg om Biogen te overtuigen, dat de rechten kocht om het geneesmiddel op mensen te testen. "De massa preklinische gegevens die Karyopharm kon voorleggen, rechtvaardigt de opwinding", zegt Laura Fanning, R&D-projectleidster voor KPT-350 bij Biogen (die de molecule tot BIIB100 herdoopte). "Het gaat hier niet zomaar om een klein staaltje van efficiëntie in één verdwaalde muis. Er is een brede bewijsbasis", zegt ze. Later dit jaar vindt een eerste op mensen toegepaste studie van KPT-350 met escalerende dosis plaats op ALS-patiënten. Als het geneesmiddel veelbelovend blijkt als middel tegen de ziekte, zal Biogen mogelijk de klinische onderzoeken uitbreiden naar andere aandoeningen, zegt Henderson.
Klinisch onderzoek
Hoewel het geneesmiddel het kennelijk goed doet in het laboratorium, is nog helemaal niet duidelijk waarom en hoe precies. "Hoe meer data, hoe onduidelijker alles wordt", stelt Haines, die nu werkt voor Regeneron Pharmaceuticals in Tarrytown, New York. Aanvankelijk gingen de meeste wetenschappers ervan uit dat het geneesmiddel voorkomt dat eiwitten zoals TDP-43 zich opstapelen in het cytoplasma door ze klem te zetten in de kern, aangezien het geneesmiddel XPO1 blokkeert. Vorig jaar echter rapporteerden Dormanns team en een ander team dat wordt geleid door Philip Thomas, een biochemicus aan het Southwestern Medisch Centrum van de University of Texas in Dallas, onafhankelijk van elkaar dat TDP-43 en een ander eiwit genaamd FUS kennelijk de kern verlaten door passieve diffusie, niet via XPO1-gemedieerd transport. (FUS vormt eveneens klonters in het cytoplasma van motorneuronen bij sommige patiënten met ALS of FTD.)
Als KPT-350 echter niet rechtstreeks ingrijpt op het transportsysteem, wat doet het dan wel? "Het lijkt erop dat het geneesmiddel een meer algemeen neurotoxisch traject als doelwit kiest", zegt Dormann, "maar we moeten nog uitklaren wat dat mechanisme precies is en welke stoornissen in het nucleair transport we corrigeren met dit geneesmiddel."
Eén mogelijkheid, zo suggereert recent onderzoek, is dat het geneesmiddel minuscule, gedrongen pakketjes van eiwitten en RNA als doelwit kiest, die zich vormen op momenten van cellulaire stress. In gezonde cellen desintegreren deze membraanloze 'stresskorrels' doorgaans en hun bestanddelen verspreiden zich nadat zich een virale infectie, een thermale shock of enig ander omgevingsincident heeft voorgedaan. Dat is echter niet het geval bij verziekte neuronen van mensen met ALS of FTD. In die cellen blijven de stresskorrels voortbestaan en worden ze plakkerig, waardoor er eiwitten zoals TDP-43 en FUS aan gaan kleven en waardoor ze uiteindelijk worden omgevormd tot solide, toxische aggregaten.
Het afgelopen jaar hebben verschillende onderzoeksteams aangetoond dat componenten van de nucleairetransportmachinerie — waaronder importers, exporters, en delen van de nucleaire poriën zelf — eveneens verstrikt kunnen raken in deze aggregaten. Het transportsysteem gaat haperen en naarmate meer TDP-43 en andere eiwitten worden toegevoegd aan de stresskorrels, treedt een feedbacklus in werking die het moleculair verkeer langzaam maar zeker stillegt. "TDP-43 is niet slechts een slachtoffer van stoornissen in het nucleo-cytoplasmisch transport", zegt Wilfried Rossoll, een neurowetenschapper aan de Mayo Clinic in Jacksonville, Florida. "Het is ook een dader."
Bevindingen uit augustus 2018 van een studie geleid door neurobioloog Ludo Van Den Bosch van het VIB–Katholieke Universiteit Leuven in België suggereerden dat het transporteiwit XPO1 als dusdanig een rol zou kunnen spelen in stresskorrels. Dat betekent dat een geneesmiddel zoals KPT-350 voornamelijk zou kunnen dienen om stresskorrels te vernietigen, waarbij de impact op het transport mogelijk bijkomstig is. "De zaken zijn complexer dan ze aanvankelijk werden voorgesteld", zegt Van Den Bosch, die heeft samengewerkt met Karyopharm.
De openstaande vragen aangaande KPT-350 hebben andere groepen er niet van weerhouden bijkomende strategieën uit te werken om de problemen met nucleair verkeer op te lossen. In 2017 bijvoorbeeld betrokken Guillaume Hautbergue en zijn collega's aan de University of Sheffield in het Verenigd Koninkrijk een andere exportfactor bij het neuronaal verlies bij ALS-vliegen met de C9orf72-mutatie. Hautbergue werkt manieren uit om dat eiwit als doelwit te kiezen om de export te voorkomen van muterende RNA's die worden geproduceerd door het gen.
Andere onderzoekers spitsen zich toe op het afbreken van stresskorrels. Die benadering zou transportfactoren en porie-eiwitten die vastzitten in deze korrels moeten bevrijden, zodat ze hun gebruikelijke plaats in de cel weer kunnen innemen, legt James Shorter uit, een eiwitbiochemicus aan de University of Pennsylvania. Hij ontwikkelt een manier om cellen uit te rusten met een gen voor de aanmaak van een 'desaggregerend' eiwit en is begonnen met het testen van de therapeutische strategie in een muizenmodel van ALS.
Enkele geneesmiddelenfabrikanten, waaronder Denali Therapeutics uit Zuid-San Francisco, Californië, en Aquinnah Pharmaceuticals uit Cambridge concentreren zich op kleine moleculen die grosso modo hetzelfde kunnen doen. Deze therapieën hebben dan misschien niet het nucleairtransporttraject tot rechtstreeks doelwit, maar ze zijn tegen hun taak opgewassen, zegt Ben Wolozin, medeoprichter en Chief Scientific Officer van Aquinnah, en neurofarmacoloog aan de Medische School van de Boston University, omdat de ontmanteling van stresskorrels bevorderlijk is voor het herstel van gezond nucleair transport. "Dit alles maakt deel uit van een geïntegreerde biologische respons", zegt Wolozin.
Aquinnah hoopt nog dit jaar zijn prioritaire verbinding te evalueren bij ALS-patiënten, ongeveer gelijktijdig met de klinische plannen van Biogen met KPT-350. Momenteel proberen de wetenschappers van Biogen nog steeds uit te vissen wat het geneesmiddel precies doet in diverse genetische modellen van de ziekte, waaronder de vliegen met de beschadigde ogen. Tot op zekere hoogte doet het er volgens Henderson echter niet toe het precieze actiemechanisme te doorgronden. "Het relevante experiment", zo besluit hij, "wordt toegepast op de menselijke patiënt."
Vertaling: Bart De Becker
Bron: Science


