C9orf72-ALS-modelmuizen: een epigenetische voltreffer?
11-07-2017
Michelle Pflumm
 Chemische veranderingen in het genoom zouden kunnen bijdragen aan ALS (Belzil et al., 2016), maar de ontwikkeling van therapieën die deze genetische schakelaars terugswitchen in modellen van de ziekte is niet eenvoudig. Het herprogrammeren van motorneuronen van mensen met ALS kan op z'n minst sommige van deze epigenetische sporen herschrijven en/of uitwissen en tegelijk een impact hebben op de herhalingsstabiliteit (Mertens et al., 2015; Cohen-Hadad et al., 2016; Almeida et al., 2013). Bovendien is het mogelijk dat dierenmodellen van ALS ze niet volledig recapituleren.
Chemische veranderingen in het genoom zouden kunnen bijdragen aan ALS (Belzil et al., 2016), maar de ontwikkeling van therapieën die deze genetische schakelaars terugswitchen in modellen van de ziekte is niet eenvoudig. Het herprogrammeren van motorneuronen van mensen met ALS kan op z'n minst sommige van deze epigenetische sporen herschrijven en/of uitwissen en tegelijk een impact hebben op de herhalingsstabiliteit (Mertens et al., 2015; Cohen-Hadad et al., 2016; Almeida et al., 2013). Bovendien is het mogelijk dat dierenmodellen van ALS ze niet volledig recapituleren.
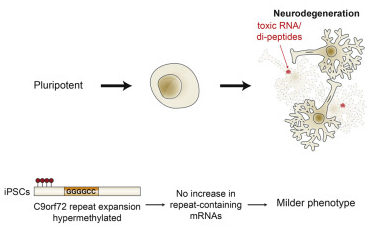
C9orf72-ALS aangestuurd door 5hmc? De hypermethylering van de promotor van het C9orf72-gen helpt mogelijk motorneuronen te beschermen doordat ze de synthese van potentieel toxische dipeptideherhalingseiwitten en herhalingbevattende RNA's doet afnemen (zie nieuws april 2015; McMillan et al., 2015, Liu et al., 2014). Verhoogde demethylering kan echter de onderdrukking van de synthese ervan ongedaan maken en zodoende bijdragen aan motorneuronentoxiciteit in de ziekte. [Cohen-Hadad et al., 2016 onder CC BY 4.0-licentie.]
Nu rapporteert een onderzoeksteam geleid door Zane Zeier van de Universiteit van Miami in Florida dat een muizenmodel van C9orf72-ALS in de hersenen cruciale epigenetische veranderingen vertoont die geassocieerd zijn met de ziekte. Deze chemische veranderingen behelzen verhoogde niveaus van 5-hydroxymethylcytosine (5hmC) ter hoogte van de geëxpandeerde promotor van het C9orf72-gen. Het gaat om cruciale chemische veranderingen die kunnen leiden tot meer dipeptideherhalingseiwitten en herhalingbevattende RNA's, die kunnen bijdragen aan de ziekte (zie conferentienieuws january 2017; Esanov et al., 2016).
De studie werd op 12 juni gepubliceerd in Molecular Neurodegeneration.
De geëxpandeerde promotor van het C9orf72-gen vertoonde ook verhoogde hypermethylering, waaronder trimethylering van histon H3’s lysine 9 (H3K9). Dat blijkt uit de analyse die was gebaseerd op chromatine-immunoprecipitatie (ChIP). Deze verhoogde methylering helpt mogelijk motorneuronen te beschermen bij op zijn minst een aantal mensen met C9orf72-ALS door de reductie van de productie van dipeptideherhalingseiwitten en herhalingsbevattende RNA's (zie nieuws april 2015; McMillan et al., 2015, Liu et al., 2014).
Het muizenmodel werd ontwikkeld door Robert Brown en zijn collega's van het Medisch Centrum van de Universiteit van Massachusetts. Het ontbeert motorsymptomen, maar vertoont cruciale kenmerken van de ziekte, waaronder de synthese van dipeptideherhalingseiwitten en herhalingsbevattende RNA's (zie nieuws december 2015; Peters et al, 2015).
De bevindingen bouwen voort op eerdere studies, geleid door Zane Zeier, waarbij verhoogde niveaus van 5hmC konden worden gedetecteerd in postmortem hersenweefsel van sommige mensen met C9orf72-ALS (Esanov et al., 2016). Deze epigenetische veranderingen, die zich voordoen gedurende het DNA-demethyleringsproces, maken de onderdrukking van het C9orf72-gen mogelijk ongedaan, waardoor de productie van dipeptideherhalingseiwitten en herhalingsbevattende RNA's mogelijk wordt (zie conferentienieuws january 2017).
Alles bij elkaar suggereren de resultaten dat geneesmiddelen die deze epigentische sporen uitwissen mogelijk helpen bij de behandeling van C9orf72-ALS, deels door het reduceren van de niveaus van dipeptideherhalingseiwitten en herhalingsbevattende RNA's, wat via meervoudige mechanismen kan bijdragen aan motorneurontoxiciteit (zie nieuws augustus 2015, maart 2017, juni 2017; Cooper-Knock et al., 2014; Freibaum et al., 2015; Zhang et al., 2015; Jovičić et al., 2015; Yin et al., 2017; Boeynaems et al., 2017).
Nu hoopt het team van Zeier potentiële behandelingsstrategieën te kunnen identificeren die deze genetische schakelaars kunnen terugswitchen in de hoop dat de motorneuronen worden beschermd bij mensen met C9orf72-ALS en FTD (zie Zeier et al., 2015). Wordt vervolgd.
Vertaling: Bart De Becker
Bron: The ALS Research Forum


