Onderzoekers van Cambridge hebben ‘minihersenen’ ontwikkeld waarmee ze een dodelijke en onbehandelbare neurologische aandoening die verlamming en dementie veroorzaakt kunnen bestuderen.
02-11-2021
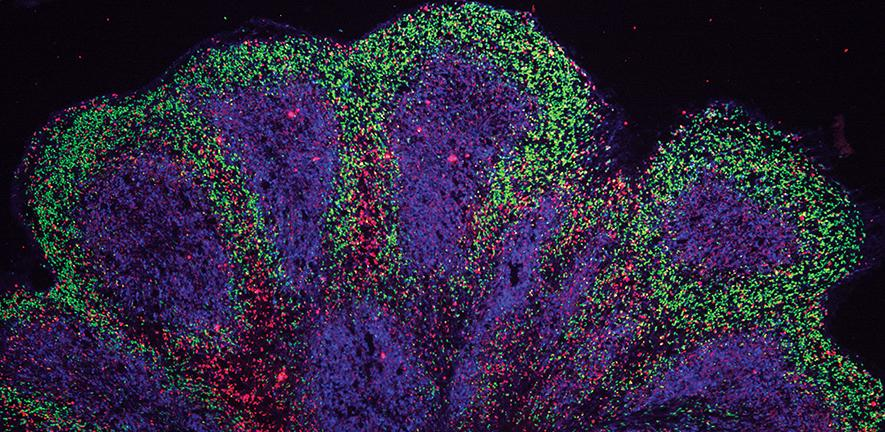
Niet alleen kunnen we zien wat er in een vroeg ziektestadium gebeurt – lang voordat de patiënt last krijgt van symptomen –we krijgen nu ook een beter beeld van hoe de storingen in elke cel geleidelijk aan onderhevig zijn aan veranderingen.
De neuronenziekte amyotrofische laterale sclerose overlapt vaak met frontotemporale degeneratie (ALS/FTD). Deze vorm kan ook jongere mensen treffen, in de leeftijdscategorie van 40 tot 45 jaar. Deze aandoeningen veroorzaken slopende symptomen zoals spierzwakte en wijzigingen aan het geheugen, het gedrag en de persoonlijkheid. Onderzoekers zijn nu in staat orgaanachtige modellen (organoïden) van de hersenen te kweken. Die stellen hen in staat beter te begrijpen wat er plaatsgrijpt tijdens de vroegste stadia van ALS/FTD, lang voordat de symptomen de kop beginnen op te steken. Ze kunnen nu ook vroeger op zoek gaan naar geneesmiddelen.
Over het algemeen worden organoïden – die vaak ‘mini-organen’ worden genoemd – meer en meer gebruikt om modellen te maken van de menselijke biologie en van ziektes bij mensen. Enkel aan de Universiteit van Cambridge gebruiken onderzoekers ze om beschadigde levers te herstellen, SARS-CoV-2-infecties van de longen te bestuderen en modellen te maken van de vroege stadia van zwangerschappen. En dit zijn nog maar enkele van de vele onderzoeksgebieden.
Meestal gebruiken de onderzoekers huidcellen die ze herprogrammeren naar hun stamcelstadium – een erg vroeg ontwikkelingsstadium waarin ze het potentieel hebben uit te groeien tot bijna elk celtype. In dit stadium kunnen ze in cultuur worden gekweekt als 3D-clusters die bepaalde aspecten van een orgaan nabootsen. Aangezien veel ziektes deels worden veroorzaakt door storingen in ons DNA, biedt deze techniek onderzoekers de mogelijkheid na te gaan hoe cellulaire veranderingen – die vaak verband houden met deze genetische mutaties – tot een ziekte leiden.
Wetenschappers van het John van Geest Centre for Brain Repair aan de Universiteit van Cambridge, gebruikten stamcellen die waren afgeleid van patiënten die lijden aan ALS/FTD om hersenorganoïden te kweken die ongeveer zo groot zijn als een erwt. Ze lijken op delen van de menselijke hersenschors inzake hun embryonale en foetale ontwikkelingsmijlpalen, hun 3D-architectuur, hun celtypediversiteit en hun interacties van cel tot cel.
Hoewel het niet de eerste keer is dat wetenschappers minihersenen hebben ontwikkeld uit patiënten met een neurodegeneratieve ziekte, was dit meestal slechts voor korte tijd en dat vertegenwoordigt een beperkt spectrum van dementie gerelateerde aandoeningen. In bevindingen die vandaag verschenen in Nature Neuroscience rapporteert de ploeg uit Cambridge dat ze deze modellen gedurende 240 dagen wist te kweken en dat ze waren afgeleid van stamcellen die de meest gangbare genetisch mutatie van ALS/FTD bevatten. Dat was eerder onmogelijk. Uit niet-gepubliceerd werk blijkt ook dat de ploeg ze wist te kweken gedurende 340 dagen.
Dr András Lakatos, de hoofdauteur die het onderzoek leidde aan het Department of Clinical Neurosciences van Cambridge, zegt hierover: “Neurodegeneratieve ziektes zijn erg complexe aandoeningen die vele verschillende celtypes kunnen aantasten en een negatieve impact kunnen hebben op de manier waarop deze cellen interageren naarmate de ziekte voortschrijdt.
“Om deze complexiteit enigszins af te spiegelen, hebben we modellen nodig die langer leven en die de samenstelling reproduceren van de menselijke hersencelpopulaties waarin zich meestal storingen voordoen. Dit is exact wat onze benadering te bieden heeft. Niet alleen krijgen we te zien wat er kan gebeuren in een vroeg stadium van de ziekte – lang voordat de patiënt last krijgt van symptomen – we kunnen ook stilaan vaststellen hoe deze storingen in de loop der tijd veranderen in elke cel.”
Organoïden worden meestal gekweekt in de vorm van celballetjes, maar hoofdauteur dr. Kornélia Szebényi genereerde van patiëntencellen afgeleide organoïde schrijfculturen in het labo van dr. Lakatos’. Dankzij deze techniek konden de meeste cellen in het model de nodige voedingsstoffen ontvangen om in leven te blijven.
Dr. Szebényi: “Wanneer de cellen samenklonteren in grotere sferen, ontvangen de cellen nabij de kern mogelijk onvoldoende voedingsstoffen. Dit kan verklaren waarom het vroeger moeilijk gebleken is voor langere tijd organoïden te kweken uit patiëntencellen.”
Dankzij deze benadering observeerden dr. Szebényi en haar collega’s in een vroeg stadium veranderingen in de cellen van de organoïden, waaronder cellulaire stress, schade aan DNA en veranderingen in de manier waarop DNA wordt omgezet in eiwitten. Deze veranderingen tastten deze zenuwcellen en hersencellen die we kennen als astroglia aan. Astroglia orkestreren de spierbewegingen en de mentale vermogens.
“Hoewel deze aanvankelijke storingen subtiel bleken, waren we verrast dat de veranderingen in ons model van ALS/FTD zich zo vroeg voordeden”, voegt dr. Lakatos hier aan toe. “Deze studie suggereert samen met andere studies dat de schade zich mogelijk vanaf de geboorte begint te ontwikkelen. Er is meer onderzoek vereist om deze veronderstelling te bevestigen of om te concluderen dat dit proces te wijten is aan de kunstmatige omstandigheden in de schaal.”
Organoïden zijn niet alleen nuttig om licht te werpen op de ziekteontwikkeling, ze kunnen ook een krachtig instrument vormen om potentiële geneesmiddelen te screenen op hun vermogen de ziektevoortgang te voorkomen of te vertragen.
Dit is een cruciaal pluspunt van organoïden. Dierenmodellen vertonen namelijk vaak niet de typische voor de ziekte relevante veranderingen, en stalen trekken uit het menselijk brein voor dit soort onderzoek is niet haalbaar.
De ploeg toonde aan dat het geneesmiddel GSK2606414 op efficiënte wijze gangbare cellulaire problemen bij ALS/FTD verlichtte, waaronder de opstapeling van giftige eiwitten, cellulaire stress en het verlies van zenuwcellen. Op die manier werd één van de trajecten die bijdragen aan de ziekte afgesloten. Gelijkaardige geneesmiddelen die geschikter zijn als medicatie en goedgekeurd zijn voor menselijke consumptie worden momenteel bestudeerd in klinisch onderzoek naar neurodegeneratieve ziektes.
Dr. Gabriel Balmus van het UK Dementia Research Institute aan de Universiteit van Cambridge is medewerkend senior auteur en zegt het volgende: “Door het modelleren van enkele mechanismen die leiden tot schade aan het DNA in zenuwcellen en door aan te tonen hoe dit kan leiden tot verscheidene vormen van cellulaire dysfunctie, zijn we mogelijk ook in staat om nieuwe potentiële geneesmiddelendoelwitten te identificeren.”
Dr. Lakatos voegt hieraan toe: “Momenteel bestaan er geen al te efficiënte behandelingsopties voor ALS/FTD, maar hoewel er nog veel werk op de plank ligt, biedt onze ontdekking ten minste de hoop dat het op termijn mogelijk wordt het ziekteproces te voorkomen of te vertragen.”
“In de toekomst wordt het misschien mogelijk huidcellen af te nemen bij een patiënt, ze te herprgrammeren om een ‘minibrein’ te kweken en dan na te gaan welke unieke combinatie van geneesmiddelen het meest geschikt is voor die specifieke patiënt.”
Vertaling: Bart De Becker
Bron: University of Cambridge


